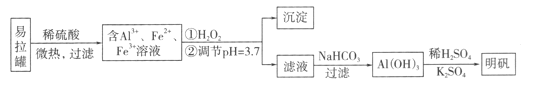
题目内容
【题目】(1)由N2、NO、CO2组成的混合气体中,三种成分的体积分数之比为1:2:1,则三种成分的质量比为________。
(2)等质量的钠和镁分别与足量的稀硫酸反应,放出气体的体积(同温同压)之比为________。
(3)同温同压下,某容器充满CO2重122 g,充满NO气体重115 g,现充满某气体B重123 g,则该气体的相对分子质量为_____。
(4)有15 g A物质和10.5 g B物质恰好完全反应生成7.2 g C物质、1.8 g D物质和0.3 mol E物质,则E物质的摩尔质量是_____g·mol-1。
(5)标准状况下,10 mL N2气体恰好与30 mL H2完全反应生成20 mL气体A,则A的分子式为_____。
【答案】7:15:11 12:23 46 55 NH3
【解析】
(1)相同条件下,气体摩尔体积相同,其体积分数之比等于其气体体积之比,其体积之比等于其物质的量之比;
(2)由2Na~H2↑,Mg~H2↑结合阿伏加德罗定律判断;
(3)根据阿伏加德罗定律判断;
(4)根据质量守恒判断;
(5)同温同压下相同体积的气体具有相同的分子数,即相同的物质的量。
(1)相同条件下,气体摩尔体积相同,其体积分数之比等于其气体体积之比,其体积之比等于其物质的量之比,所以这三种气体的物质的量之比为1:2:1,
根据m=nM知,
其质量之比=(1×28g/mol):(2×30g/mol):(1×44g/mol)=7:15:11;
(2)设钠、镁的质量为1g,
n(Na)=![]() =
=![]() mol,由2Na~H2↑可知,生成n(H2)=
mol,由2Na~H2↑可知,生成n(H2)=![]() ×
×![]() mol=
mol=![]() mol,
mol,
n(Mg)=![]() =
=![]() mol,由Mg~H2↑可知,生成n(H2)=
mol,由Mg~H2↑可知,生成n(H2)=![]() mol,
mol,
同温同压下气体的物质的量与体积成正比,则放出气体的体积(同温同压)之比为![]() mol:
mol:![]() mol =12:23;
mol =12:23;
(3)充满CO2时44x+y=122g;
充满NO时30x+y=115;
解得:x=0.5, y=100;
充满某气体B时0.5×M+100=123
解得M=46
故该气体相对分子质量为46;
(4)15gA物质和10.5gB物质完全反应,生成7.2gC物质,1.8gD物质和0.3molE物质,由质量守恒定律可知,反应前后的物质的质量和相等,则E的质量为:15g+10.5g-7.2g-1.8g=16.5g,E的物质的量为0.3mol,
所以E的摩尔质量为![]() =55g/mol;
=55g/mol;
(5)同温同压下相同体积的气体具有相同的分子数,即相同的物质的量,则标准状况下,10 mL N2气体恰好与30 mL H2完全反应生成20 mL气体A,N2、H2、A的物质的量之比为1:3:2,则A的分子式为NH3。

【题目】向2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)△H=QkJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
物质的量(mol) 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃时,该反应的平衡常数K=___________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是______(填字母编号)。
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2mol B、0.1molD、0.1mol E
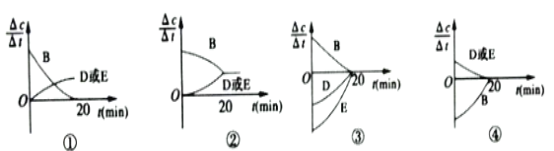
(3)对于该反应,用各物质的反应速率与时间的关系曲线表示如下,示意图中的___________(填序号)正确。
(4)容器的体积和温度T1℃不变,向该容器中加入1.60molB、0.20molD、0.20molE和0.4molA,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是___________。
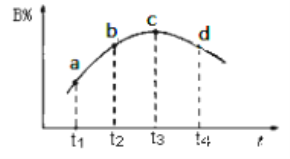
(5)若该密闭容器绝热,实验测得B的转化率随温度变化如图所示。由图可知,Q_________0(填“大于”或“小于),c点v正__________v逆(填“大于”、“小于”或“等于”)。
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
I.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_______________作指示剂。
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为____________mL。

(4)滴定。当____________时,停止滴定,并记录NaOH溶液的最终读数.再重复滴定3次。
Ⅱ.实验记录
实验数据(mL) 滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理:
(5)某同学在处理数据时计算得:平均消耗的NaOH溶液的体积 V=![]() =15.24mL。指出他的计算的不合理之处:____________________________________。按正确数据处理,可得市售白醋总酸量=____________g/100mL。(结果保留四位有效数字)
=15.24mL。指出他的计算的不合理之处:____________________________________。按正确数据处理,可得市售白醋总酸量=____________g/100mL。(结果保留四位有效数字)
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)____________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加入少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出