题目内容
【题目】(1)某元素原子M层电子数是K层电子数的一半,该元素的原子结构示意图是______________。
(2)碘的质子数为53,碘有多种核素,其中中子数为74的核素的原子符号是________。
(3)某阳离子ARn+,核外共有x个电子,则该原子核内的中子数为 __________。
【答案】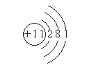
![]() A―x―n
A―x―n
【解析】
(1)根据元素核外电子排布规律进行分析;
(2)根据质量数=中子数+质子数计算;
(3)根据中子数=质量数-质子数及阳离子核外电子数=质子数-|所带电荷数|。
(1)元素原子核外M层电子数是K层电子数的一半,说明元素原子有三个电子层,从内到外每一个电子层上的电子数分别为2、8、1,所以元素原子的原子序数为11,为钠元素,所以钠原子的原子结构示意图为: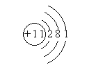 ;
;
(2)碘的质子数为53,中子数为74的核素,质量数为53+74=127,核素的原子符号可表示为![]() ;
;
(3)某阳离子ARn+,核外共有x个电子,则该原子核内的质子数为x+n,中子数=质量数-质子数=A-(x+n)=A-x-n。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
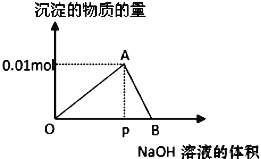
【题目】E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)![]() G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
温度℃ | 25 | 80 | 230 |
平衡常数值 | 5×104 | 2 | 1.9× 10﹣5 |
A.上述反应是熵增反应
B.25℃时,反应G(g)![]() E(s)+4F(g)的平衡常数值是0.5
E(s)+4F(g)的平衡常数值是0.5
C.在80℃时,测得某时刻,F、G浓度均为0.5 mol·L﹣1,则此时v(正)>v(逆)
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大