题目内容
【题目】已知常温下各物质的溶度积或电离平衡常数如下:
Ksp(CuS)=1.3×10-36,Ksp(FeS)=6.5×10-18
H2S:Ka1=1.2×10-7,Ka2=7×10-15
一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;如果一个反应的平衡常数小于10-5,则认为该反应很难进行。请回答:
(1)向浓度均为0.1 mol·L-1的FeSO4和CuSO4的混合溶液中加Na2S溶液,请写出首先出现沉淀的离子方程式________________。
当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+)∶c(Cu2+)=________。
(2)通过计算说明反应CuS(s)+2H+=Cu2++H2S进行的程度________________。
(3)常温下,NaHS溶液呈碱性,此时溶液中离子浓度由大到小的顺序是_________。
若向此溶液中加入CuSO4溶液,恰好完全反应,所得溶液的pH________(填“>”“<”或“=”)7。用离子方程式表示其原因____________。
【答案】Cu2++S2-=CuS↓ 5.0×1018 反应很难进行 c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+) < HS-+Cu2+=CuS↓+H+
【解析】
(1)因为Ksp(CuS)=1.3×10-36<Ksp(FeS)=6.5×10-18,所以c(Fe2+)=c(Cu2+)的情况下,首先出现CuS沉淀,故首先出现沉淀的离子方程式为:Cu2++S2-=CuS↓;溶液中出现两种沉淀,说明FeS也出现沉淀,故![]() ;
;
(2)因为![]() ,
, ,
, ,又因为反应CuS(s)+2H+=Cu2++H2S的平衡常数为:
,又因为反应CuS(s)+2H+=Cu2++H2S的平衡常数为: ,结合题干可知反应很难进行;
,结合题干可知反应很难进行;
(3)NaHS溶液呈碱性,故HS-的水解程度大于电离程度,又水会电离出OH-,故溶液中离子浓度由大到小的顺序是c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+);因为发生的离子反应为:HS-+Cu2+=CuS↓+H+,故溶液显酸性,pH<7。

【题目】C1O2是常用的自来水消毒剂。
I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 =2C1O2+2NaCl,装置如下图所示:
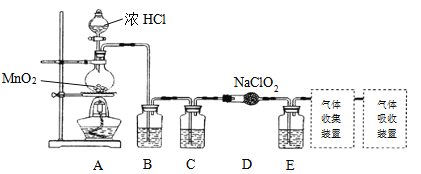
(1)圆底烧瓶内发生反应的化学方程式是:__________。
(2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示:
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 溶 |
B、C、E装置中的试剂依次是_________(填序号)。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。
(3)Fe2+消除ClO2-的离子方程式为_______。
(4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释)___________。