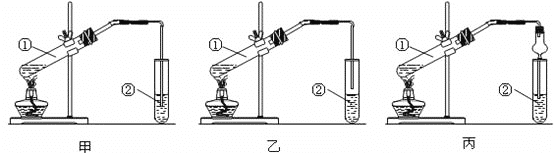
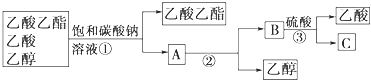
题目内容
【题目】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体![]() 在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液
在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液![]() 和C反应发出苍白色火焰
和C反应发出苍白色火焰![]() 请回答:
请回答:

(1)B是 ______ ,C是 ______ ![]() 请填写化学式
请填写化学式![]() ;
;
(2)反应![]() 的化学方程式 ______ ;
的化学方程式 ______ ;
【答案】Cl2 H2 2Fe+3Cl2 ![]() 2FeCl3
2FeCl3
【解析】
A是常见的金属单质、单质B是黄绿色气体,为氯气,单质C是无色气体,B和C反应发出苍白色火焰,说明C为氢气,则E为氯化氢,E溶液为盐酸,盐酸和A反应生成氢气和F,F为淡绿色溶液,说明为氯化亚铁,A为铁。D为氯化铁。
A是常见的金属单质、单质B是黄绿色气体,为氯气,单质C是无色气体,B和C反应发出苍白色火焰,说明C为氢气,则E为氯化氢,E溶液为盐酸,盐酸和A反应生成氢气和F,F为淡绿色溶液,说明为氯化亚铁,A为铁。D为氯化铁。
(1)B为氯气,Cl2,C为氢气,H2;
(2)反应![]() 的化学方程式为2Fe+3Cl2
的化学方程式为2Fe+3Cl2 ![]() 2FeCl3。
2FeCl3。

【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
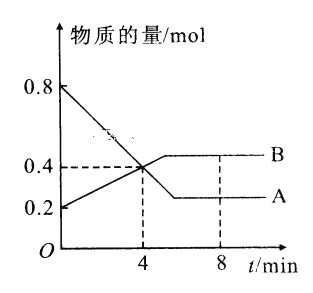
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
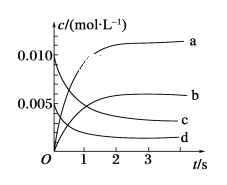
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
【题目】E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)![]() G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
温度℃ | 25 | 80 | 230 |
平衡常数值 | 5×104 | 2 | 1.9× 10﹣5 |
A.上述反应是熵增反应
B.25℃时,反应G(g)![]() E(s)+4F(g)的平衡常数值是0.5
E(s)+4F(g)的平衡常数值是0.5
C.在80℃时,测得某时刻,F、G浓度均为0.5 mol·L﹣1,则此时v(正)>v(逆)
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大