题目内容
【题目】按要求回答下列问题
(1)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________,X的相对原子质量是________。
(2)标准状况,1L 水中通入 aL HCl 气体,忽略盐酸溶液中 HCl的挥发,得到的盐酸溶液密度为 b g/mL,则溶质的物质的量浓度为 __________mol/L
(3)某同学写出以下化学方程式(未配平)NO+HNO3―→N2O3+H2O该应中氧化剂是________(写化学式,下同) ;方程中出现的4种物质中还原性最强的物质是________。
【答案】62 g/mol 16 ![]() HNO3 NO
HNO3 NO
【解析】
(1)12.4 g Na2X中含有0.4 mol钠离子,则Na2X的摩尔质量为![]() =62g/mol,由Na2X的相对分子质量为62可知,X的相对原子质量为(62—23×2)=16,故答案为62g/mol;16;
=62g/mol,由Na2X的相对分子质量为62可知,X的相对原子质量为(62—23×2)=16,故答案为62g/mol;16;
(2)标准状况,aL HCl 气体的物质的量为![]() mol,质量为
mol,质量为![]() mol×36.5g/mol=
mol×36.5g/mol=![]() g,标准状况,1L 水中通入 aL HCl 气体得到溶液的质量为(1000+
g,标准状况,1L 水中通入 aL HCl 气体得到溶液的质量为(1000+![]() )g,溶液的体积为
)g,溶液的体积为![]() ×10—3L/ml,则溶质的物质的量浓度为
×10—3L/ml,则溶质的物质的量浓度为![]() =
=![]() mol/L,故答案为
mol/L,故答案为![]() ;
;
(3)由化学方程式可知,反应中NO中的N元素化合价升高被氧化,NO是还原剂,HNO3中的N元素化合价降低被还原,HNO3是氧化剂,N2O3即是氧化产物又作还原产物,由还原剂的还原性强于还原产物可知,还原性最强的是NO,故答案为HNO3;NO。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
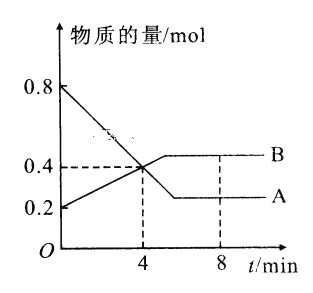
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
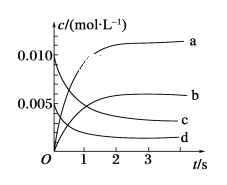
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变