题目内容
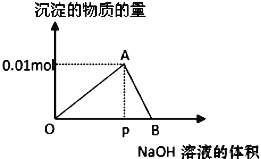
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入足量NaOH溶液,充分反应后消耗 a mol NaOH ,另取一份加入足量盐酸,充分反应后消耗b mol HCl,则该混合溶液中c(Na+)为 ( )(已知:NH4++ OH—= NH3·H2O)
A.(![]() )mol/LB.(5a—
)mol/LB.(5a—![]() )mol/L
)mol/L
C.(10b-5a) mol/LD.(2b-a) mol/L
【答案】C
【解析】
NH4HCO3 + 2NaOH = NH3·H2O+ Na2CO3 + H2O,消耗 a mol NaOH,则NH4HCO3物质的量为0.5a mol,另取一份加入足量盐酸,充分反应后消耗b mol HCl,又由于NH4HCO3 + HCl = NH4Cl + CO2↑+ H2O,0.5a mol碳酸氢铵消耗0.5a mol盐酸,因此碳酸钠消耗盐酸的物质的量为(b-0.5a)mol,因此钠离子物质的量为(b-0.5a)mol,混合溶液中c(Na+)为![]() ,故C正确。
,故C正确。
综上所述,答案为C。

【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
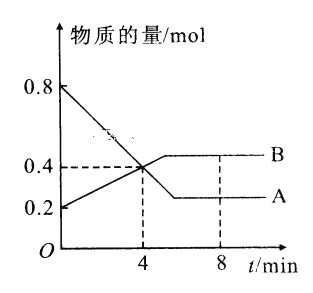
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
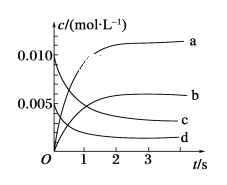
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变