题目内容
【题目】请按要求写出相应的方程式
⑴某小组同学合作探究铝铁混合物分离的工艺流程如下图甲:


图甲 图乙
①气体A能使湿润的红色石蕊试纸变蓝,则加热时“反应1”的离子方程式为______(用单线桥标出反应电子转移的方向和数目)。
②“反应2”的离子方程式为______。
③气体A能发生如图乙所示的转化,该转化的总反应的化学方程式为______。
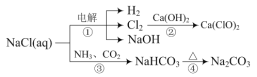
⑵由工业废气制备Na2S2O4的实验原理如下:

①“氧化”时Ce(SO4)2转化为Ce2(SO4)3,NO气体转化为HNO2和HNO3,产物中HNO2和HNO3物质的量之比为3∶1,写出“氧化”反应的化学方程式:______。
②写出“电解”反应的离子方程式:_____。
【答案】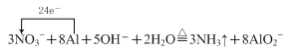 AlO2-+ CO2+2H2O=Al(OH)3↓ +HCO3- 2NH3+3NaClO=N2+3NaCl+3H2O 4NO+6 Ce(SO4)2+5H2O=3 HNO2+HNO3+3Ce2(SO4)3+3H2SO4 2Ce3++2SO32 +4H+
AlO2-+ CO2+2H2O=Al(OH)3↓ +HCO3- 2NH3+3NaClO=N2+3NaCl+3H2O 4NO+6 Ce(SO4)2+5H2O=3 HNO2+HNO3+3Ce2(SO4)3+3H2SO4 2Ce3++2SO32 +4H+![]() S2O42-+2Ce4++2H2O
S2O42-+2Ce4++2H2O
【解析】
⑴①气体A能使湿润的红色石蕊试纸变蓝,说明该气体具有碱性,故A为氨气,则加热时金属铝和硝酸钠、氢氧化钠溶液发生氧化还原反应生成氨气和偏铝酸钠,铝化合价升高作还原剂,硝酸钠中氮元素化合价降低,作氧化剂,根据得失电子守恒,物料守恒,“反应1”的离子方程式为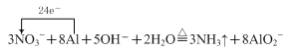 ;
;
答案为: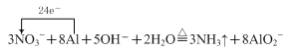 。
。
②由“反应1”得到的滤液中含有偏铝酸根离子,通入过量二氧化碳,生成氢氧化铝白色沉淀和碳酸氢钠,“反应2”的离子方程式为AlO2-+ CO2+2H2O=Al(OH)3↓+HCO3-;
答案为:AlO2-+ CO2+2H2O=Al(OH)3↓+HCO3-。
③如图乙所示,发生的反应为①NaClO+H2O=NaOH+HClO;②3HClO+2NH3= N2+3H2O+3HCl;③NaOH+ HCl=NaCl+ H2O;①×3+②+③×3,可得2NH3+3NaClO=N2+3NaCl+3H2O,
答案为:2NH3+3NaClO=N2+3NaCl+3H2O。
⑵ 由工业废气制备Na2S2O4的实验原理如下:
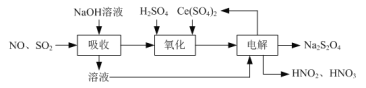
①依据流程图,一氧化氮和二氧化硫混合气体通入氢氧化钠溶液,二氧化硫被吸收生成亚硫酸钠,用硫酸调节溶液pH值,一氧化氮与Ce(SO4)2发生氧化还原反应,Ce(SO4)2转化为Ce2(SO4)3,NO气体转化为HNO2和HNO3,产物中HNO2和HNO3物质的量之比为3∶1,结合得失电子守恒和料守恒,反应的化学方程式:4NO+6 Ce(SO4)2+5H2O=3 HNO2+HNO3+3Ce2(SO4)3+3H2SO4
答案为:4NO+6 Ce(SO4)2+5H2O=3HNO2+HNO3+3Ce2(SO4)3+3H2SO4。
②根据流程图,对吸收流程产生的Na2SO3和氧化后的Ce2(SO4)3的酸性混合溶液电解生成Ce(SO4)2和Na2S2O4,根据电荷守恒及物料守恒, “电解”反应的离子方程式:2Ce3++2SO32 +4H+![]() S2O42-+2Ce4++2H2O。
S2O42-+2Ce4++2H2O。
答案为:2Ce3++2SO32 +4H+![]() S2O42-+2Ce4++2H2O。
S2O42-+2Ce4++2H2O。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案