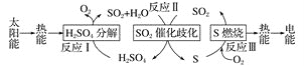
جâؤ؟ؤعبف
،¾جâؤ؟،؟CCl3CHO؟ةح¨¹،°CH3CH2OH£«4Cl2،ْCCl3CHO£«5HCl،±½ّذذضئ±¸،£
¢إتµرéتز³£سأKMnO4،¢MnO2»ٍNaClOسëإ¨رخثل·´س¦ضئب،Cl2،£ضتء؟·ضتخھ36.5%£¬أـ¶بخھ1.18 g،¤cm£3رخثل£¬ئنخïضتµؤء؟إ¨¶بخھ______mol،¤L1،£µبخïضتµؤء؟µؤKMnO4،¢MnO2»ٍNaClOسë×مء؟إ¨رخثل·´س¦£¬ہيآغةدةْ³ةµؤCl2µؤضتء؟ض®±بخھ______،£
¢ئ؟ةسأبçدآ·½·¨²â¶¨ثùضئCCl3CHO´ضئ·µؤ´؟¶ب£¨شسضت²»²خسë·´س¦£©£؛³ئب،¸أتµرéضئ±¸µؤ²ْئ·5.00 g£¬إن³ة100.00 mLبـز؛£¬ب،ئنضذ10.00 mL£¬¼سبëز»¶¨ء؟µؤNaOH؛َ£¬¼سبë30.00 mL 0.100 mol،¤L1µؤµâ±ê×¼ز؛£¬سأ0.100 mol،¤L1µؤNa2S2O3بـز؛µخ¶¨£¬ضط¸´ةدتِ3´خ²ظ×÷£¬دû؛ؤNa2S2O3بـز؛ئ½¾ùجه»خھ20.00 mL،£تµرéضذثù·¢ةْ·´س¦بçدآ£؛CCl3CHO£«NaOH£½CHCl3£«HCOONa£¬HCOONa£«I2£½HI£«NaI£«CO2،ü£¬ I2£«2Na2S2O3£½2NaI£«Na2S4O6£¬¼ئثم´ضئ·ضذثù؛¬CCl3CHOµؤضتء؟·ضت£¨ذ´³ِ¼ئثم¹³ج£©،£_____________
،¾´ً°¸،؟11.8 5،أ2،أ2 59£¥
،¾½âخِ،؟
¢إضتء؟·ضتخھ36.5%£¬أـ¶بخھ1.18 g،¤cm£3رخثل£¬رخثلخïضتµؤء؟إ¨¶بخھ![]() =11.8 mol،¤L1£»µبخïضتµؤء؟µؤKMnO4،¢MnO2»ٍNaClOسë×مء؟إ¨رخثل·´س¦£¬·´س¦ضذKMnO4،¢MnO2»ٍNaClO¾ùخھرُ»¯¼ء£¬رُ»¯¼ءµأµ½µؤµç×سش½¶à£¬ةْ³ةµؤآبئّش½¶à£¬ةèKMnO4،¢MnO2»ٍNaClO¾ùخھ1mol£¬شٍKMnO4µأµç×ستخھ1mol،ء(7-2)£¬MnO2µأµç×ستخھ1mol،ء(4-2)£¬NaClOµأµç×ستخھ1mol،ء[1-(-1)]£»ةْ³ةµؤCl2µؤضتء؟ض®±ب=Cl2µؤخïضتµؤء؟ض®±ب=1mol،ء(7-2)£؛1mol،ء(4-2)£؛1mol،ء[1-(-1)]=5:2:2£»
=11.8 mol،¤L1£»µبخïضتµؤء؟µؤKMnO4،¢MnO2»ٍNaClOسë×مء؟إ¨رخثل·´س¦£¬·´س¦ضذKMnO4،¢MnO2»ٍNaClO¾ùخھرُ»¯¼ء£¬رُ»¯¼ءµأµ½µؤµç×سش½¶à£¬ةْ³ةµؤآبئّش½¶à£¬ةèKMnO4،¢MnO2»ٍNaClO¾ùخھ1mol£¬شٍKMnO4µأµç×ستخھ1mol،ء(7-2)£¬MnO2µأµç×ستخھ1mol،ء(4-2)£¬NaClOµأµç×ستخھ1mol،ء[1-(-1)]£»ةْ³ةµؤCl2µؤضتء؟ض®±ب=Cl2µؤخïضتµؤء؟ض®±ب=1mol،ء(7-2)£؛1mol،ء(4-2)£؛1mol،ء[1-(-1)]=5:2:2£»
´ً°¸خھ£؛5:2:2،£
¢ئ¸ù¾ف·´س¦CCl3CHO£«NaOH£½CHCl3£«HCOONa£¬HCOONa£«I2£½HI£«NaI£«CO2،ü£¬ I2£«2Na2S2O3£½2NaI£«Na2S4O6£¬؟ةµأCCl3CHO~ I2~2Na2S2O3£¬
10.00 mL بـز؛ضذ£¬n£¨CCl3CHO£©=![]() n£¨Na2S2O3£©=0.100 mol،¤L1،ء20.00 mL،ء10-3=0.002mol£¬
n£¨Na2S2O3£©=0.100 mol،¤L1،ء20.00 mL،ء10-3=0.002mol£¬
شٍ£؛100.00 mLبـز؛ضذn£¨CCl3CHO£©=0.002mol،ء![]() =0.02mol£¬´ضئ·ضذثù؛¬CCl3CHOµؤضتء؟·ضتخھ
=0.02mol£¬´ضئ·ضذثù؛¬CCl3CHOµؤضتء؟·ضتخھ![]() =59%
=59%
´ً°¸خھ£؛59%،£

،¾جâؤ؟،؟ؤ³»¯ر§ذ،×éزش»·¼؛´¼![]() ضئ±¸»·¼؛د©،£زرضھ£؛
ضئ±¸»·¼؛د©،£زرضھ£؛
أـ¶ب£¨g/cm3£© | بغµم£¨،و£© | ·ذµم£¨،و£© | بـ½âذش | |
»·¼؛´¼ | 0.96 | 25 | 161 | ؤـبـسعث® |
»·¼؛د© | 0.81 | ©پ103 | 83 | ؤربـسعث® |
(1)ضئ±¸´ضئ·½«12.5 mL»·¼؛´¼¼سبëتش¹ـAضذ£¬شظ¼سبë1 mLإ¨ءٍثل£¬ز،شب؛َ·إبëثé´ةئ¬£¬»؛آ¼سببضء·´س¦حêب«£¬شعتش¹ـCؤعµأµ½»·¼؛د©´ضئ·،£
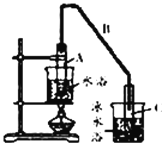
¢ظذ´³ِ»·¼؛´¼ضئ±¸»·¼؛د©µؤ»¯ر§·´س¦·½³جت½£؛_________،£
¢عAضذثé´ةئ¬µؤ×÷سأتا_____________£¬µ¼¹ـB³ءثµ¼ئّح⻹¾كسذµؤ×÷سأتا_____________،£
¢غتش¹ـCضأسع±ùث®ش،ضذµؤؤ؟µؤتا_______________________،£
(2)»·¼؛د©´ضئ·ضذ؛¬سذ»·¼؛´¼؛حةظء؟ثلذششسضتµب£¬ذèزھجل´؟،£
¢ظ¼سبë±¥؛حت³رخث®£¬صٌµ´،¢¾²ضأ،¢·ض²م£¬ث®شع______²م£¨جîةد»ٍدآ£©£»·ضز؛؛َسأ_________£¨جîبë±à؛إ£©د´µس،£
a£®KMnO4بـز؛ b£®د، H2SO4 c£®Na2CO3بـز؛
¢عشظ½«»·¼؛د©ببءَ£¬صôءَت±زھ¼سبëةْت¯»ز£¬ؤ؟µؤتا__________،£
¢غتص¼¯²ْئ·ت±£¬؟طضئµؤخآ¶بس¦شع_________×َسز،£
(3)زشدآاّ·ض»·¼؛د©¾«ئ·؛ح´ضئ·µؤ·½·¨£¬؛دہيµؤتا_______،£
a£®سأثلذش¸كأجثل¼طبـز؛ b£®سأ½ًتôؤئ c£®نهث®
،¾جâؤ؟،؟ز»¶¨خآ¶بدآ£¬10 mL 0.40 mol،¤L£1 H2O2بـز؛·¢ةْ´ك»¯·ض½â،£²»ح¬ت±؟ج²âµأةْ³ةO2µؤجه»(زرصغثمخھ±ê×¼×´؟ِ)بç±ي،£
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
دآءذذًتِ²»صب·µؤتا(بـز؛جه»±ن»¯؛ِآش²»¼ئ)
A.·´س¦µ½6 minت±£¬c(H2O2)£½0.30 mol،¤L£1
B.0،«6 minµؤئ½¾ù·´س¦ثظآت£؛v(H2O2)،ض3.3،ء10£2 mol،¤L£1،¤min£1
C.6،«10 minµؤئ½¾ù·´س¦ثظآت£؛v(H2O2)<3.3،ء10£2 mol،¤L£1،¤min£1
D.·´س¦µ½6 minت±£¬ H2O2·ض½âءث50%
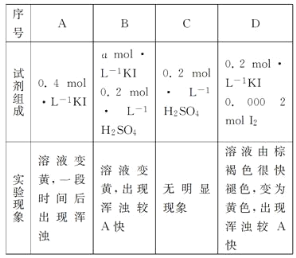
،¾جâؤ؟،؟¢ٌ.¼¸ضض¶جضـئعشھثطµؤش×س°ë¾¶¼°ض÷زھ»¯؛د¼غبçدآ±ي£؛زرضھXتا¶جضـئعضذ×î»îئأµؤ½ًتô£¬ازسëRح¬ضـئع،£(اëسأدàس¦µؤ»¯ر§سأسï´ًجâ)
شھثط´ْ؛إ | X | Y | Z | M | R |
ش×س°ë¾¶/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
ض÷زھ»¯؛د¼غ | £«1 | £«6 £2 | £«5 £3 | £2 | £«3 |
(1)Rµؤشھثط·û؛إخھ________£»Mشعشھثطضـئع±يضذµؤخ»ضأخھ________________،£
(2)XسëY°´ش×س¸ِت±ب1،أ1¹¹³ةµؤخïضتµؤµç×ست½خھ________________£»ثù؛¬»¯ر§¼üہàذح__________________________،£
(3)X£«،¢Y2£،¢M2£ہë×س°ë¾¶´َذ،ث³ذٍخھ__________________،£
(4)½«YM2ح¨بëFeCl3بـز؛ضذµؤہë×س·½³جت½£؛_________________________________________،£
¢ٍ.بçح¼×ھ»¯¹طدµ£¨A،¢B،¢Cضذ؛¬دàح¬شھثط£©
![]()
![]()
![]()
![]()
![]()
(1)بôBخھ°×ة«½؛×´²»بـخشٍAسëC·´س¦µؤہë×س·½³جت½خھ_________________________،£
(2)بôدٍBبـز؛ضذµخ¼سجْا軯¼طبـز؛»ل²ْةْجطص÷ہ¶ة«³ءµي£¬شٍAسëC·´س¦ةْ³ةBµؤہë×س·½³جت½خھ_____________________________________________،£