题目内容
【题目】向xmL 0. 1 mol/L氨水中滴加等物质的量浓度的稀H2SO4 ,测得混合溶液的温度和pOH[pOH==-lg c(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化)。下列说法不正确的是

A. x=40
B. a, b,c三点由水电离出的c(H+)依次减小
C. b点时溶液的pOH>pH
D. a,b.d三点对应的NH3·H2O的电离常数:K(b)>K(d)>K(a)
【答案】B
【解析】
A.b点时溶液温度最高,表明此时酸、碱恰好反应完全,因1mol硫酸可与2mol氨水反应,因加入的硫酸与氨水等物质的量浓度,故x=40,A项正确;
B.a点时溶液中的溶质为(NH4)2SO4和NH3·H2O,b点时恰好反应完为(NH4)2SO4,c点时溶液中的溶质为(NH4)2SO4与H2SO4,酸、碱都抑制水的电离,铵根离子水解是促进水的电离,则b点由水电离出的c(H+)最大,B项错误;
C.B点时恰好反应生成(NH4)2SO4,为强酸弱碱盐,溶液呈酸性,pOH>pH,C项正确;
D.a、b、d三点的温度高低顺序为b>d>a,氨水的电离是一个吸热过程,温度越高,NH3·H2O的电离常数越大,D项正确;
所以答案选择B项。

 阅读快车系列答案
阅读快车系列答案【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
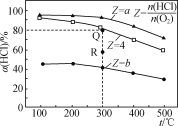
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1









