题目内容
【题目】常温时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol·L-1的混合溶液,溶液中c(CO32-)、c(HCO3-)与pH的关系如图所示。下列说法中错误的是
(己知:CO32-+H2O![]() HCO3-+OH- K=2×10-4,1g5=0.7)
HCO3-+OH- K=2×10-4,1g5=0.7)
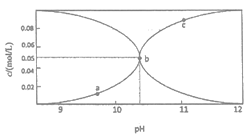
A. a点的溶液中:c(HCO3-)>c(H2CO3)+c(CO32-)
B. b点横坐标数值大约为10.3
C. c点的溶液中:c(Na+)<2c(CO32-)十c(HCO3-)
D. 溶液中水的电离程度:a<b<c
【答案】C
【解析】分析:本题考查电解质溶液中水的电离、盐的水解等知识点。
详解:A. a点的溶液中主要是碳酸氢钠溶液,碳酸氢根离子水解程度大于碳酸氢根离子的电离程度, 结合c(CO32-)+c(HCO3-)+ c(H2CO3)=0.100mol·L-1,c(HCO3-)>0.05 mol·L-1,溶液中离子浓度大小c(HCO3-)>c(H2CO3)+c(CO32-),所以A选项是正确的;B.b点c(CO32-)=c(HCO3-)=0.05mol/L, 因为CO32-+H2O![]() HCO3-+OH- ,K=
HCO3-+OH- ,K=![]() =c(OH-)=2×10-4,c(H+)=5
=c(OH-)=2×10-4,c(H+)=5![]() 10-11,pH=-lg(5
10-11,pH=-lg(5![]() 10-11),所以B选项是正确的;
10-11),所以B选项是正确的;
C.c点溶液中,c(OH-)>c(H+),溶液中存在电荷守恒, c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+), c(Na+)>2c(CO32-)+c(HCO3-)故C错误;D.a、b、c三点溶液中所含Na2CO3依次增多,所含NaHCO3依次减少,越弱越水解,对水的电离促进越大,即溶液中水的电离程度:a<b<c,所以D正确;所以C选项是正确的。

练习册系列答案
相关题目