题目内容
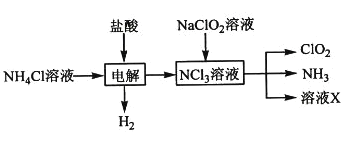
【题目】以NaCl为原料可制取下列物质,下列说法正确的是

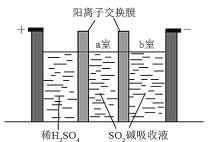
A.工业上是用阴离子交换膜电解槽作为反应①的发生装置
B.漂白粉久置于空气中变质时既发生非氧化还原反应,也发生氧化还原反应
C.反应③是侯氏制碱法,生产过程中先通入CO2,再通入NH3
D.可以用澄清石灰水检验反应④后所得固体中是否有NaHCO3存在
【答案】B
【解析】
A. 电解饱和食盐水,阴极上水得电子放出氢气生成氢氧根,钠离子向阴极移动,形成氢氧化钠,应使用阳离子交换膜,故A错误;
B. 漂白粉久置于空气中与二氧化碳和水反应生成次氯酸,发生非氧化还原反应,次氯酸分解生成氧气和氯化氢,发生氧化还原反应,故B正确;
C. 侯氏制碱法,生产过程中先通入NH3,形成碱性溶液额,再通入CO2,增大CO2的溶解度,提高产率,故C错误;
D. 碳酸钠和碳酸氢钠都可与澄清石灰水反应生成白色沉淀,不能检验碳酸氢钠的存在,故D错误;
答案选B。

【题目】某化学小组以环己醇![]() 制备环己烯。已知:
制备环己烯。已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
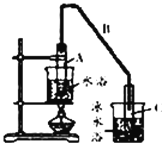
①写出环己醇制备环己烯的化学反应方程式:_________。
②A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_____________。
③试管C置于冰水浴中的目的是_______________________。
(2)环己烯粗品中含有环己醇和少量酸性杂质等,需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在______层(填上或下);分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环己烯热馏,蒸馏时要加入生石灰,目的是__________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水