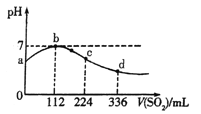
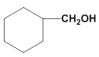
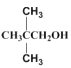
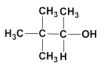
题目内容
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂:某学习小组为探究其分解产物设计如下实验装置。

硫酸亚铁铵在500 ℃时隔绝空气加热完全分解,固体产物可能有 FeO和Fe2O3,气体产物可能有NH3、SO3、SO2、N2和H2O
(1)A 中固体充分加热较长时间后,通入氮气,目的是 _______________ 。
(2)能证明气体产物中有SO2 的实验现象是____________
(3)设计一个实验方案,用化学方法证明固体产物不含二价铁:________________
【答案】使分解产生的气体在B、C中被吸收充分 C 中产生白色浑浊 取少量固体样品,加入稀硫酸溶解,加入酸性KMnO4溶液,不褪色(或加入K3Fe(CN)6溶液,不产生蓝色沉淀)
【解析】
硫酸亚铁铵在500℃时隔绝空气加热完全分解,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、SO2、N2和H2O,SO3溶于水反应产生硫酸,装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊,C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+。据此解答。
硫酸亚铁铵在500℃时隔绝空气加热完全分解,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、SO2、N2和H2O,装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊,C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+。
(1)待A中固体充分加热较长时间后,通入氮气目的是使分解生成的气体在B、C装置中完全吸收;
(2)SO2与H2O2会发生反应:SO2+H2O2=H2SO4,反应产生的硫酸与BaCl2溶液发生复分解反应:Ba2++SO42-=BaSO4↓,BaSO4是白色沉淀,因此能证明气体产物中有SO2的实验现象是C中生成了白色沉淀;
(3)利用二价铁离子具有还原性设计实验检验其存在,实验设计为:取少量固体于试管中,加稀硫酸溶解,然后向其中滴入酸性KMnO4溶液,若酸性KMnO4溶液不褪色,证明此固体产物不含二价铁。

 阅读快车系列答案
阅读快车系列答案