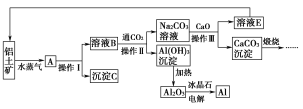
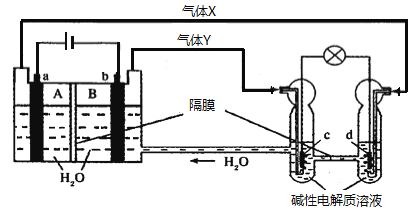
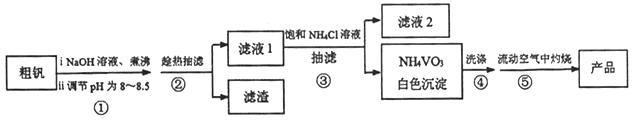
题目内容
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
Ⅰ.汽车尾气中的SO2可用石灰水来吸收,生成CaSO3浊液。已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9 常温下测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=__________ 。CaSO3易变质为CaSO4,水垢中含有较多的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为:_________;
Ⅱ.已知25℃时,NH3H2O电离常数Kb=1.8×10-5,Ksp[Mg(OH)2]=1.0×10-11,向0.4mol/L的氨水中加入等体积浓度为6×10-4mol/L MgCl2 溶液,________沉淀生成(填“无”或“有”),并简述理由______;若某溶液中C(Mg2+)=1.2×10-3mol/L,需向其中加入等体积的NaOH溶液浓度为_____ mol/L时,可使Mg2+恰好沉淀完全(忽略溶液体积变化)。
Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=2,则溶液显____________色。
②能说明第①步反应达平衡状态的是_____________。
A.Cr2O72-和CrO42-的浓度相同 B.2v (Cr2O72-) =v (CrO42-) C.溶液的颜色不变
③第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
④第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
【答案】 4.2×10-9 CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq) 有 因为C(OH-)=(KbC)1/2,Qc=C(Mg2+)C(OH-)2=1.08×10-9>Ksp 4.4×10-3 橙 c 6 5
CaCO3(s)+SO42-(aq) 有 因为C(OH-)=(KbC)1/2,Qc=C(Mg2+)C(OH-)2=1.08×10-9>Ksp 4.4×10-3 橙 c 6 5
【解析】Ⅰ由Ka2(H2SO3)=6.0×10-9可知SO32-+H2O![]() HSO3-+OH-的水解平衡常数
HSO3-+OH-的水解平衡常数![]() 。常温下,测得某纯CaSO3与水形成的浊液pH为9,忽略第二步水解可以得到:c(HSO3-)=c(OH-)=1×10-5mol/L,可知
。常温下,测得某纯CaSO3与水形成的浊液pH为9,忽略第二步水解可以得到:c(HSO3-)=c(OH-)=1×10-5mol/L,可知 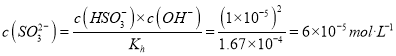 。又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5 mol/L,所以Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9。碳酸钙比硫酸钙更难溶,可以通过增大碳酸根浓度的方法将硫酸钙转化为碳酸钙,反应为:CaSO4(s)+CO
。又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5 mol/L,所以Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9。碳酸钙比硫酸钙更难溶,可以通过增大碳酸根浓度的方法将硫酸钙转化为碳酸钙,反应为:CaSO4(s)+CO![]() (aq)
(aq)![]() CaCO3(s)+SO
CaCO3(s)+SO![]() (aq)。
(aq)。
Ⅱ、氨水存在电离平衡:NH3·H2O![]() NH4+ + OH,忽略水电离,认为铵根离子浓度等于氢氧根离子浓度,考虑电离的氨水很少,所以NH3·H2O的浓度近似就是0.2mol/L(注意溶液体积是原来2倍,各自浓度都是一半)。根据平衡常数可以计算c(OH-)=
NH4+ + OH,忽略水电离,认为铵根离子浓度等于氢氧根离子浓度,考虑电离的氨水很少,所以NH3·H2O的浓度近似就是0.2mol/L(注意溶液体积是原来2倍,各自浓度都是一半)。根据平衡常数可以计算c(OH-)=![]() 。c(Mg2+)=3×10-4mol/L,所以Qc=3×10-4×
。c(Mg2+)=3×10-4mol/L,所以Qc=3×10-4×![]() =1.08×10-9>Ksp,所以有沉淀。
=1.08×10-9>Ksp,所以有沉淀。
Ⅲ:①若平衡体系的pH=2,在酸性环境下,化学反应平衡正向移动,溶液显示橙色。
②a.Cr2O72-和CrO42-的浓度相同,没有强调不变,所以不一定平衡,故a错误;b.式中未说明反应速率是指正反应还是逆反应,无法判断是不是平衡状态,故b错误;c.溶液的颜色不变,证明各组分的浓度不随时间的变化而变化,故c正确。
③第②步中,还原1molCr2O72-离子,即得到了6mol的电子,根据氧化还原反应中的电子守恒,硫酸亚铁中的亚铁离子变为三价铁离子失去1个电子,所以需要6mol的FeSO4·7H2O。
④c(Cr3+)降至10-5mol/L, ![]() ,所以pH=5。
,所以pH=5。

【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中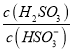 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。