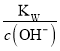题目内容
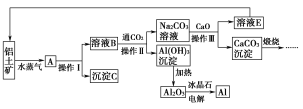
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
请回答下列问题:
(1)请说出沉淀C在工业上的一种用途:_____________________。
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有_____(填化学式)。
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是________(填操作名称)。实验室洗涤Al(OH)3沉淀的方法是__________________________________________。
(4)电解熔融的氧化铝,若得到标准状况下22.4 L O2,则同时生成铝的质量为________g。
(5)写出Na2CO3溶液与CaO反应的离子方程式:_____________________。
【答案】红色颜料、炼铁等(回答一种即可) CaO、CO2过滤向沉淀中加水至浸没沉淀,等水流出后,重复数次36CO32-+H2O+CaO===CaCO3↓+2OH-
【解析】
氧化铝是两性氢氧化物,和氢氧化钠溶液反应,氧化铁和氢氧化钠溶液不反应,根据溶液B中通入二氧化碳生成氢氧化铝可知B中含有偏铝酸钠,所以B是偏铝酸钠溶液,C是氧化铁,实现固体和液体的分离的方法是过滤,氢氧化铝受热分解得到氧化铝和水,电解氧化铝得到的是金属铝和氧气,碳酸钠溶液与氧化钙反应生成碳酸钙沉淀和氢氧化钠,溶液E是氢氧化钠,据此解答。
(1)根据以上分析可知C是氧化铁,在工业上的用途有红色颜料、炼铁等;
(2)据流程图可看出循环使用的物质除NaOH、H2O外,还有CaCO3![]() CaO+CO2↑,CaO与CO2也可循环使用;
CaO+CO2↑,CaO与CO2也可循环使用;
(3)操作Ⅰ、Ⅱ、Ⅲ均是除去不溶于液体的固体,方法为过滤,洗涤Al(OH)3沉淀的方法是向漏斗中加蒸馏水至浸没沉淀,使水自然流完,重复操作2~3次;
(4)电解熔融的氧化铝,若得到标准状况下22.4 L O2,即1mol氧气,则根据原子守恒可知同时生成铝的质量为![]() ;
;
(5)Na2CO3溶液与CaO反应生成碳酸钙和氢氧化钠,反应的离子方程式为CO32-+H2O+CaO=CaCO3↓+2OH-。

【题目】现有常温下的四种溶液(如下表):
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH =11 | pH =11 | C=0.002mol/L | C=0.002mol/L |
下列有关叙述中正确的是
A. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
B. 在④、②两种溶液等体积混合,所得溶液pH=3
C. 四种溶液由水电离出氢离子的浓度从大到小的顺序是③>①>②>④
D. 将①、④两种溶液等体积混合,溶液中c(OH-) >c(H+ )