题目内容
16.解释下列物质性质的变化规律时,与共价键的键能无关的是( )| A. | N2比P4的化学性质稳定 | |
| B. | F2、C12、Br2、I2的沸点逐渐升高 | |
| C. | 金刚石的熔点比晶体硅高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
分析 A.N≡N的键能比P-P键大,N2分子较稳定;
B.F2、C12、Br2、I2的沸点与分子间作用力大小有关;
C.原子晶体的共价键越强,则硬度越大,熔点越高;
D.分子中键能越大,其氢化物越稳定.
解答 解:A.N≡N的键能比P-P键大,N2分子较稳定,与共价键有关,故A不选;
B.F2、Cl2、Br2、I2的相对分子质量在增大,分子间作用力增大,则熔、沸点在增大,与键能无关,故B选;
C.金刚石中键能大于硅中的键能,则金刚石的硬度大,熔点高,与键能有关,故C不选;
D.非金属性F>Cl>Br>I,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,与键能有关,故D不选.
故选B.
点评 本题考查键能的大小比较及元素周期律的递变规律,题目难度不大,注意把握晶体类型的判断以及影响晶体熔沸点高低的因素.

练习册系列答案
相关题目
2.2-甲基-1,3-丁二烯和足量的溴发生加成反应,其加成产物有(不考虑立体异构)( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
4.下列化学用语正确的是( )
| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 四氯化碳的比例模型  | |
| C. | 氧原子的电子排布图  | |
| D. | ${\;}_{8}^{16}$O2-离子的结构示意图: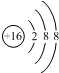 |
1. 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )| A. | a为正极是金属铜,b为负极是金属锌 | |
| B. | a极上H+得到电子,发生氧化反应 | |
| C. | b极金属发生反应(或称被腐蚀),发生氧化反应 | |
| D. | 该装置将化学能转变为电能 |
5.下列烯烃中存在顺反异构体的是( )
| A. | 丙烯 | B. | 1-丁烯 | C. | 2-戊烯 | D. | 2-甲基-2-丁烯 |
 ;
;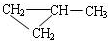 ;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
;该产物中核磁共振氢谱峰面积(由小到大)之比为1:3:4.
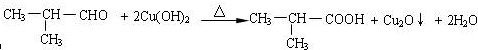 ;
; .
.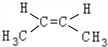 、
、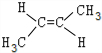 .
.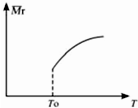 在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g
在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g