题目内容
1. 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )| A. | a为正极是金属铜,b为负极是金属锌 | |
| B. | a极上H+得到电子,发生氧化反应 | |
| C. | b极金属发生反应(或称被腐蚀),发生氧化反应 | |
| D. | 该装置将化学能转变为电能 |
分析 原电池是把化学能转变为电能的装置,原电池放电时,电子从负极流向正极,所以b为负极,较活泼的金属作负极,所以负极上锌失电子发生氧化反应,a为正极,正极上氢离子得电子发生还原反应,据此分析.
解答 解:A、原电池放电时,电子从负极流向正极,所以b为负极,较活泼的金属作负极,则负极为锌,a为正极为不活泼金属铜,故A正确;
B、a为正极,正极上氢离子得电子发生还原反应,故B错误;
C、b为负极,较活泼的金属作负极,所以负极上锌失电子发生氧化反应,故C正确;
D、该装置是原电池,原电池是把化学能转变为电能的装置,故D正确;
故选B.
点评 本题考查了原电池原理,根据原电池的定义、正负极上发生的电极反应、电子的流向和电流的流向分析解答即可,难度不大.

练习册系列答案
相关题目
6.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 同温同压同体积的CO2和SO2所含氧原子数均为2NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 1L1.0mol•L-1NH4Cl与2L 0.5mol•L-1NH4Cl溶液含NH4+数目相同 |
9.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 将10ml0.1mol•L-1Na2CO3溶液逐滴滴加到10ml0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) | |
| B. | 若将CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N前<N后 |
16.解释下列物质性质的变化规律时,与共价键的键能无关的是( )
| A. | N2比P4的化学性质稳定 | |
| B. | F2、C12、Br2、I2的沸点逐渐升高 | |
| C. | 金刚石的熔点比晶体硅高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
13.有机物分子间或原子与原子团间的相互影响会导致物质化学物质的不同,下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 酚和醇的羟基性质差别较大 |
10.下列化学用语书写正确的是( )
| A. | 乙炔的最简式:CHCH | B. | 甲基苯的官能团为: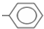 | ||
| C. | 丙烷分子的球棍模型示意图: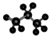 | D. | -CH3(甲基)的电子式为: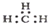 |
 .
.