题目内容
8.某有机化合物A由碳、氢、氧三种元素组成,其相对分子质量大于110、小于150.经分析得知,其中氧的质量分数为47.76%.请回答:(1)该化合物分子中含有氧原子数是4个,写出简要分析过程.
(2)该化合物的相对分子质量是134.
(3)该化合物的分子式是C5H10O4.
分析 (1)根据含氧量和相对分子质量的范围,得出氧原子数的范围,最终确定分子中含有的氧原子数目;
(2)根据氧元素的质量分数、分子中含有的氧原子数目求出有机化合物的相对分子质量;
(3)根据相对分子质量和分子中含有的氧原子数目计算化学式.
解答 解:(1)由题意知,氧的质量分数为47.76%,由有机化合物的相对分子质量大于110,小于150,即分子中氧原子个数为大于$\frac{110×0.4776}{16}$=3.28,小于$\frac{150×0.4776}{16}$=4.48,所以氧原子为4个,故答案为:4;
(2)分子中氧原子为4个,氧的质量分数为47.76%,则有机化合物分子质量=$\frac{16×4}{0.4776}$=134,所以有机化合物的相对分子质量是134,故答案为:134;
(3)分子中氧原子为4个,所以C、H的相对原子质量之和为:134-16×4=70,根据商余法可得:$\frac{70}{14}$=5,则该有机物的化学式为:C5H10O4,故答案为:C5H10O4.
点评 本题考查了有机物分子式的确定,题目难度中等,注意掌握质量守恒定律、商余法在确定有机物分子式中的应用方法,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.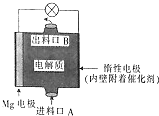 镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
 镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )
镁燃料电池是一种环境友好型的高性能电源,如图是Mg-NaClO燃料电池的示意图,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,下列判断不正确的是( )| A. | 惰性电极是该电池的正极 | |
| B. | 电解质中的多数ClO-向电池的负极移动 | |
| C. | 电池中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| D. | 进料口A进入的是NaClO溶液,而出料口B输出的则是NaCl溶液 |
16.解释下列物质性质的变化规律时,与共价键的键能无关的是( )
| A. | N2比P4的化学性质稳定 | |
| B. | F2、C12、Br2、I2的沸点逐渐升高 | |
| C. | 金刚石的熔点比晶体硅高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
3.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
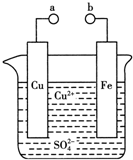

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu | |
| C. | a和b用导线相连时,电能转变为化学能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
13.有机物分子间或原子与原子团间的相互影响会导致物质化学物质的不同,下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生反应 | |
| D. | 酚和醇的羟基性质差别较大 |
20.XY2是由短周期元素形成的化合物,Y-比X2+多一个电子层,它与氩原子的电子层结构相同.下列有关叙述不正确的是( )
| A. | X是第二周期元素 | B. | Y是第ⅦA族元素 | ||
| C. | Y-与X2+的最外层电子数相同 | D. | 化合物XY2的化学键为离子键 |
18.有机物 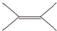 的二氯代物有( )
的二氯代物有( )
 的二氯代物有( )
的二氯代物有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
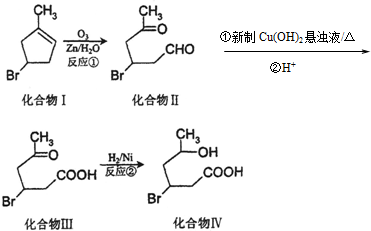
 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$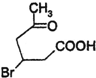 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.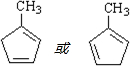 .
. .
.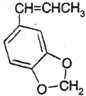 发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为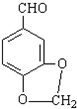 .
.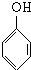 +nHCHO$\stackrel{浓盐酸}{→}$
+nHCHO$\stackrel{浓盐酸}{→}$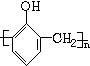 +nH2O.
+nH2O.