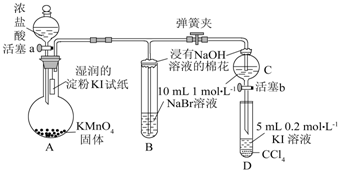
题目内容
6.离子方程式BaCO3+2H+=Ba2++CO2↑+H2O中的H+不能代表的物质是( )①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH.
| A. | ①③ | B. | ①④⑤ | C. | ②④⑤ | D. | ②⑤ |
分析 依据离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+中的H+是溶于水的强酸溶液中发生的反应,同时不能和钡离子反应生成沉淀分析.
解答 解:①HCl溶于水完全电离,且不和钡离子反应,可以代表碳酸钡和盐酸反应的离子方程式,故①不选;
②H2SO4于水完全电离,但硫酸根离子和钡离子结合会生成硫酸钡沉淀,离子方程式为BaCO3+2H++SO42-=BaSO4+CO2↑+H2O不可以代表碳酸钡和硫酸反应的离子方程式,故②选;
③HNO3溶于水完全电离,不和钡离子反应可以代表;可以代表碳酸钡和硝酸反应的离子方程式,故③不选;
④NaHSO4中的硫酸根离子和钡离子结合生成沉淀硫酸钡,离子方程式为BaCO3+2H++SO42-=BaSO4+CO2↑+H2O不可以代表碳酸钡和硫酸氢钠反应的离子方程式,故④选;
⑤CH3COOH是弱酸存在电离平衡,不能写成氢离子的形式,离子方程式BaCO3+2CH3COOH=Ba2++2CH3COO-+CO2↑+H2O不可以代表碳酸钡和乙酸反应的离子方程式,故⑤选;
故选C.
点评 本题考查了离子反应的实质分析,主要是离子的存在和离子反应的分析理解,提供氢离子的同时,不能和钡离子反应是解题关键,题目较简单.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
16.解释下列物质性质的变化规律时,与共价键的键能无关的是( )
| A. | N2比P4的化学性质稳定 | |
| B. | F2、C12、Br2、I2的沸点逐渐升高 | |
| C. | 金刚石的熔点比晶体硅高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
18.有机物 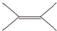 的二氯代物有( )
的二氯代物有( )
 的二氯代物有( )
的二氯代物有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
15.下列关于化合物CH3-CH=CH-C≡C-CH3说法中,正确的是( )
| A. | 6个碳原子都在一条直线上 | B. | 有可能5个碳原子在一条直线上 | ||
| C. | 6个碳原子都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
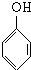 +nHCHO$\stackrel{浓盐酸}{→}$
+nHCHO$\stackrel{浓盐酸}{→}$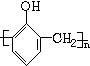 +nH2O.
+nH2O.

 .
.