题目内容
【题目】(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-221 kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式为: _______________。
(2)工业上可以在恒容密闭容器中采用下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K=______。由上表数据判断,该反应的△H_______ 0(填“>”、“=”或“<”)。升高温度,正反应速率________填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为_______,此时的温度为_______。
③欲提高CO的转化率,可采取的措施是______ 。(填序号)
A.升温 B.加入更高效的催化剂 C.恒容条件下充入CO
D.恒容条件下充入H2 E.恒容条件下充入氦气 F.及时移走CH3OH
【答案】2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.5kJ/mol
N2(g)+2CO2(g) △H=-746.5kJ/mol ![]() < 增大 80% 250℃ DF
< 增大 80% 250℃ DF
【解析】
(1)根据盖斯定律,将三个热化学方程式叠加,就可得到相应反应的热化学方程式;
(2)①根据平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比得化学平衡常数表达式;根据升高温度,化学平衡向吸热反应方向移动,结合温度与平衡常数、化学反应速率及反应放热、吸热关系分析解答;
③化学平衡向右移动可以提高CO的转化率,但是不能加入CO。
(1)①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
②2C(s)+O2(g)=2CO(g) △H2=-221 kJ/mol
③C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
③×2-②-①,整理可得2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=746.5kJ/mol;
N2(g)+2CO2(g) △H=746.5kJ/mol;
(2)①由于平衡常数等于可逆反应达到平衡状态时,各生成物浓度幂之积与反应物浓度幂之积的比,可得该反应的化学平衡常数表达式K=![]() ;根据表格的温度与平衡常数的关系可知:升高温度,平衡常数减小,说明升高温度,平衡逆向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以该反应的正反应为放热反应,故△H<0;升高温度,分子的内能增加,分子之间的有效碰撞次数增加,因此正反应速率增大;
;根据表格的温度与平衡常数的关系可知:升高温度,平衡常数减小,说明升高温度,平衡逆向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以该反应的正反应为放热反应,故△H<0;升高温度,分子的内能增加,分子之间的有效碰撞次数增加,因此正反应速率增大;
②可逆反应: CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
c(开始)(mol/L) 1 3 0
c(变化)(mol/L) 0.8 1.6 0.8
c(平衡)(mol/L) 0.2 1.4 0.8
则CO的平衡转化率=![]() ×100%=80%,该温度下的化学平衡常数K=
×100%=80%,该温度下的化学平衡常数K=![]() =
=![]() =2.041,所以实验温度是250℃;
=2.041,所以实验温度是250℃;
③A.升温,化学平衡逆向移动,使CO的转化率减小,A错误;
B.加入更高效的催化剂,化学平衡不移动,物质的转化率不变,B错误;
C.恒容条件下充入CO,会使CO转化率减小,C错误;
D.恒容条件下充入H2,可以使平衡右移,CO转化率增大,D正确;
E.恒容条件下充入氦气,不能使化学平衡发生移动,因此CO的转化率不变,E错误;
F.及时移走CH3OH,即减小生成物的浓度,平衡正向移动,CO转化率增大,F正确;
故合理选项是DF。

 阅读快车系列答案
阅读快车系列答案【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
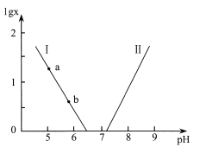
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。

②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060