题目内容
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
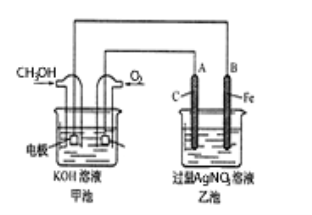
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。

②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。
【答案】增大盐酸的浓度(或将镍废料研成粉末等) 5.0~7.1 NaCl 2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O 10 g/L 2H++2e-=H2 ↑(或2NH4++2H2O+2e-=2NH3·H2O+H2↑) 2[NiC2O4·2H2O]![]() Ni2O3+3CO↑+CO2↑+4H2O
Ni2O3+3CO↑+CO2↑+4H2O
【解析】
酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢可以将Fe2+氧化为Fe3+,加入Na2CO3溶液调节溶液的pH,使Fe3+、Al3+全部形成沉淀,向过滤后的滤液中再加入碳酸钠可以形成NiCO3沉淀,滤液A中含有NaCl等物质,将NiCO3溶于盐酸,得NiCl2溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3,据此分析解答。
(1)用盐酸溶解镍金属废料时,为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌,还可以将镍废料研成粉末增大接触面积,还可以通过增大盐酸的浓度的方法;
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,先加入H2O2溶液,可以将Fe2+氧化为Fe3+,然后加Na2CO3溶液,控制溶液pH,使杂质Fe3+、Al3+形成Fe(OH)3、Al(OH)3沉淀,要求沉镍前要将铝离子和铁离子沉淀完全,而镍离子不能产生沉淀,根据离子沉淀的pH数值可知:溶液的pH值控制在4.7~7.1;
(3)前面用盐酸溶解镍金属废料,其中含有HCl,向溶液中加入了Na2CO3,二者会发生反应产生NaCl,加入Na2CO3溶液调整溶液的pH,形成的Fe(OH)3、Al(OH)3沉淀进入滤渣,得到的滤液中再加入Na2CO3溶液,调整溶液的pH至>9.2,形成的主要是Ni(OH)2沉淀,还含有少量的NiCO3沉淀;此时的滤液A中主要含有氯化钠、Na2CO3,可回收利用,
(4)沉淀中含有Ni(OH)2、NiCO3,用HCl溶解,Ni(OH)2、NiCO3转化为Ni2+,向溶液中加入NaClO、NaOH,在碱性条件下,NiCl2、NaClO发生氧化还原反应,Cl元素由+1价降低到-1价,反应生成NaCl,而Ni元素则由+2价升高到+3价,生成Ni2O3,根据电子守恒、电荷守恒及原子守恒,可得反应离子方程式为:2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O;
(5)①结合图示,阴极电流效率及镍的成粉率越高越好,根据图2可知,NH4Cl的浓度为10g/L时,镍的成粉率最高,所以NH4Cl的浓度最好控制为10g/L;
②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,在阴极上溶液中的H+放电,产生氢气,所以相应的电极反应式:2H++2e-=H2 ↑,也可写为:2NH4++2H2O+2e-=2NH3·H2O+H2↑;
(6)草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体,根据元素守恒可知混合气体为CO和CO2的混合气体,则反应为:2[NiC2O4·2H2O]![]() Ni2O3+3CO↑+CO2↑+4H2O。
Ni2O3+3CO↑+CO2↑+4H2O。

 名校课堂系列答案
名校课堂系列答案【题目】(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-221 kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式为: _______________。
(2)工业上可以在恒容密闭容器中采用下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
CH3OH(g),下表所列数据为该反应在不同温度下的化学平衡常数:
温度/℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①反应的平衡常数表达式为K=______。由上表数据判断,该反应的△H_______ 0(填“>”、“=”或“<”)。升高温度,正反应速率________填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为_______,此时的温度为_______。
③欲提高CO的转化率,可采取的措施是______ 。(填序号)
A.升温 B.加入更高效的催化剂 C.恒容条件下充入CO
D.恒容条件下充入H2 E.恒容条件下充入氦气 F.及时移走CH3OH