题目内容
15.已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )| A. | 所得溶液中的c(H+)=1.0×10-13 mol•L-1 | |
| B. | 所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol•L-1 | |
| C. | 所加的烧碱溶液的pH=13.0 | |
| D. | 所得溶液中的c(Mg2+)=5.6×10-10 mol•L-1 |
分析 A.根据pH=-lg[c (H+)]计算;
B.溶液中由水电离产生的c(OH-)水=c (H+)水=10-PHmol•L-1;
C.根据烧碱与MgCl2溶液反应生成沉淀,消耗了NaOH溶液;
D.根据溶度积计算即可.
解答 解:A.pH=13的溶液中,c (H+)=10-13mol/L,故A正确;
B.由水电离产生的c(OH-)水=c (H+)水=10-PHmol•L-1=10-13mol/L,故B正确;
C.因为向MgCl2溶液中加NaOH溶液后混合溶液的pH=13,所以所加NaOH溶液pH>13,故C错误;
D.Mg(OH)2的溶度积常数Ksp=5.6×10-12,溶液中的c (Mg2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=5.6×10-10 mol/L,故D正确,
故选C.
点评 本题考查平衡常数及沉淀的生成,注意溶度积常数的利用,把握影响pH与浓度的关系、水的电离等即可解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列单体中在一定条件下发生加聚反应生成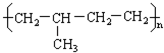 的是( )
的是( )
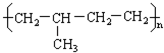 的是( )
的是( )| A. | CH2=CH2和CH4 | B. |  | ||
| C. | CH3-CH=CH2和CH2=CH2 | D. | 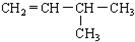 |
3.设NA为阿伏加德罗常数.下列说法错误的是( )
| A. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA | |
| B. | 常温常压下,64 g O2和O3混合气体中含有原子总数为4NA | |
| C. | 1mol Cl2与NaOH溶液反应,转移的电子总数为2NA | |
| D. | 标准状况下,22.4L N2含共用电子对数为3NA |
10.下表中实验操作、现象以及所得出的结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向1mL 2mol•L-1 NaOH溶液加入2滴0.1mol•L-1 MgCl2溶液,再滴加2滴0.1mol•L-1 FeCl3溶液 | 先生成白色沉淀, 后生成红褐色沉淀 | Fe(OH)3比Mg(OH)2 更难溶 |
| B | 向NH3•H2O溶液中滴加少量AgNO3溶液 | 无明显现象 | NH3•H2O和AgNO3 不反应 |
| C | 向试管中某溶液加入NaOH溶液 | 试管口湿润的红色石蕊试纸不变蓝 | 溶液中无NH4+ |
| D | 浓硫酸加入Cu片后,加热 | 有白色固体生成 | 白色固体为CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
4.在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-.下列说法正确的是( )
| A. | Na2CO3溶液:c(Na+)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 升高温度,溶液pH减小 | |
| C. | 稀释溶液,溶液中所有离子浓度都减小 | |
| D. | 加入Ba(OH)2固体c(CO32-)增大 |
5.脑白金是热卖中的一种滋补品,其有效成分的结构简式如图.下列对该化合物的叙述正确的是 ( )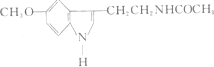

| A. | 它属于芳香烃 | B. | 它属于高分子化合物 | ||
| C. | 分子式为C13 H15N2O2 | D. | 在一定条件下可以发生加成反应 |
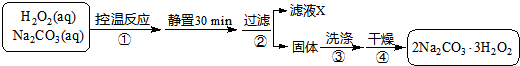 图1
图1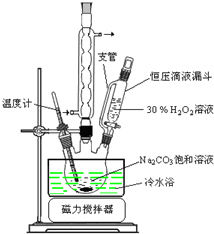
 H2O
H2O CO2
CO2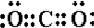 .
.