题目内容
10.下表中实验操作、现象以及所得出的结论都正确的是( )| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向1mL 2mol•L-1 NaOH溶液加入2滴0.1mol•L-1 MgCl2溶液,再滴加2滴0.1mol•L-1 FeCl3溶液 | 先生成白色沉淀, 后生成红褐色沉淀 | Fe(OH)3比Mg(OH)2 更难溶 |
| B | 向NH3•H2O溶液中滴加少量AgNO3溶液 | 无明显现象 | NH3•H2O和AgNO3 不反应 |
| C | 向试管中某溶液加入NaOH溶液 | 试管口湿润的红色石蕊试纸不变蓝 | 溶液中无NH4+ |
| D | 浓硫酸加入Cu片后,加热 | 有白色固体生成 | 白色固体为CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氢氧化钠过量,不发生沉淀的转化;
B.Ag+与NH3•H2O先生成AgOH沉淀,当氨水过量时生成银氨溶液;
C.滴加NaOH稀溶液,不生成氨气;
D.硫酸铜是白色固体.
解答 解:A.向1mL 2mol•L-1 NaOH溶液加入2滴0.1mol•L-1 MgCl2溶液,再滴加2滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀,氢氧化钠过量,不发生沉淀的转化,故A错误;
B.Ag+与NH3•H2O先生成AgOH沉淀,当氨水过量时生成银氨溶液,溶液变澄清,所以Ag+与NH3•H2O能反应,故B错误;
C.滴加NaOH稀溶液,不生成氨气,应滴加浓NaOH并加热,然后检验氨气,方案不合理,故C错误;
D.浓硫酸加入Cu片后,加热生成硫酸铜,硫酸铜是白色固体,故D正确.
故选D.
点评 本题考查较为综合,涉及沉淀转化、物质检验以及元素化合物知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度大不,注意把握实验操作的原理和实验方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.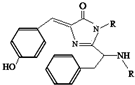 美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
 美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )| A. | 该有机物属于芳香烃 | |
| B. | 该有机物能发生水解反应,且1mol该有机物需消耗氢氧化钠2mol | |
| C. | 该有机物能与溴水发生取代反应消耗Br2 3mol | |
| D. | 该有机物既能与盐酸反应,又能与碳酸氢钠溶液反应 |
5.下列实验合理的是( )
| A. | 用HNO3除去铜粉中混杂的Zn | |
| B. | 通入足量Cl2,除去Fe2(SO4)3溶液中的FeSO4 | |
| C. | 依次通过溴水和碱石灰,除去CH4中的乙烯 | |
| D. | 通过饱和Na2CO3溶液,除去CO2中混杂的SO2 |
15.已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
| A. | 所得溶液中的c(H+)=1.0×10-13 mol•L-1 | |
| B. | 所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol•L-1 | |
| C. | 所加的烧碱溶液的pH=13.0 | |
| D. | 所得溶液中的c(Mg2+)=5.6×10-10 mol•L-1 |
2.A、B、C、D、E是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表:
(1)E元素基态原子的电子排布式是1s22s22p63s23p63d64s2;
(2)比较B与O元素的第一电离能:B>O,A与C的电负性:A<C (填<,=或>);A D形成的一种常见化合物,常温下为液体,是良好的有机溶剂,其分子中含有的共价键类型是σ键.(填“σ键”或“π键”).
(3)写出工业上制备D单质的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
(4)E单质在海水中易发生电化学腐蚀,写出正极的电极反应式O2+2H2O+4e-=4OH-;
(5)在一定条件下,B与D可形成一种化合物,该化合物分子中每个原子最外层均为8电子,常温下为淡黄色液体,遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:NCl3+3H2O═NH3+3HClO.
(6)己知单质B生成4.25g气态氢化物W时,释放出11.55KJ的热量.写出该反应的热化学方程式N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol.
| 元素 | 结构或性质信息 |
| A | 其原子最外层电子数是内层电子数的2倍 |
| B | 基态原子最外层电子排布为nSnnPn+1 |
| C | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| D | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的P电子 |
| E | 其与A形成的合金为目的用量最多的金属材料 |
(2)比较B与O元素的第一电离能:B>O,A与C的电负性:A<C (填<,=或>);A D形成的一种常见化合物,常温下为液体,是良好的有机溶剂,其分子中含有的共价键类型是σ键.(填“σ键”或“π键”).
(3)写出工业上制备D单质的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
(4)E单质在海水中易发生电化学腐蚀,写出正极的电极反应式O2+2H2O+4e-=4OH-;
(5)在一定条件下,B与D可形成一种化合物,该化合物分子中每个原子最外层均为8电子,常温下为淡黄色液体,遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:NCl3+3H2O═NH3+3HClO.
(6)己知单质B生成4.25g气态氢化物W时,释放出11.55KJ的热量.写出该反应的热化学方程式N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol.
19.能够鉴定溴乙烷中溴元素的存在的操作是( )
| A. | 在溴乙烷中直接加入AgNO3溶液 | |
| B. | 在溴乙烷中加蒸馏水,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中加入NaOH溶液,加热后酸化,然后加入AgNO3溶液 | |
| D. | 在溴乙烷中加入乙醇加热后,然后加入AgNO3溶液 |
20.下列对实验现象或操作的解释不合理的是( )
| 操作及现象 | 解释 | |
| A | 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出 | 蛋白质发生了变性 |
| B | 盛放浓NaOH溶液的试剂瓶用玻璃塞久置后,瓶塞很难打开 | NaOH腐蚀玻璃,生成的硅酸钠将瓶口与瓶塞粘在一起 |
| C | 配制FeCl3溶液时加入适量盐酸酸化 | 抑制Fe3+水解,防止所配制溶液变浑浊 |
| D | 二氧化硫通入溴水,溴水褪色 | 说明二氧化硫具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
 ;D的核磁共振氢谱共有3组峰.
;D的核磁共振氢谱共有3组峰.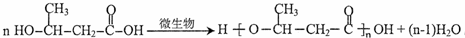 .
.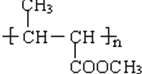
 .
.