题目内容
3.设NA为阿伏加德罗常数.下列说法错误的是( )| A. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA | |
| B. | 常温常压下,64 g O2和O3混合气体中含有原子总数为4NA | |
| C. | 1mol Cl2与NaOH溶液反应,转移的电子总数为2NA | |
| D. | 标准状况下,22.4L N2含共用电子对数为3NA |
分析 A、SO2和O2的反应是可逆反应,不能进行彻底;
B、根据氧气和臭氧均由氧原子构成来分析;
C、氯气与碱的反应为歧化反应;
D、求出氮气的物质的量,然后根据1mol氮气中含3mol共用电子对来分析.
解答 解:A、SO2和O2的反应是可逆反应,不能进行彻底,即不能彻底反应生成2molSO3,故混合气体的物质的量大于2mol,分子数大于2NA个,故A正确;
B、氧气和臭氧均由氧原子构成,故64g混合气体中的氧原子的物质的量n=$\frac{64g}{16g/mol}$=4mol,即个数为4NA,故B正确;
C、氯气与碱的反应为歧化反应,1mol氯气转移1mol电子,即NA个,故C错误;
D、标况下,22.4L氮气的物质的量为1mol,而1mol氮气中含3mol共用电子对,即3NA个,故D正确.
故选C.
点评 本题考查了物质的量的有关计算,难度不大,应注意的是物质的结构特点和公式的应用.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
14.下列关于有机物的叙述错误的是( )
| A. | 石油气、煤油和石蜡的主要成分都是碳氢化合物 | |
| B. | 含碳的化合物不一定都是有机物 | |
| C. | 由CH2=CH-COOCH3合成的聚合物为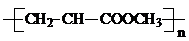 | |
| D. | 苯不具有典型双键所应具有的加成反应,故不可能发生加成反应 |
11.下列关于同分异构体判断正确的是( )
| A. | 分子式为C2H6O的同分异构体有两个,分别是CH3OCH3和CH3CH2OH | |
| B. | 分子式为C8H10的芳香烃有3种,分别为 、 、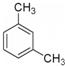 、 、 | |
| C. | 分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 | |
| D. | 二氯甲烷是正四面体结构, 和 和 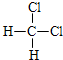 是同一种物质 是同一种物质 |
18.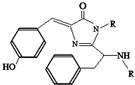 美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
 美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖.经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的( )| A. | 该有机物属于芳香烃 | |
| B. | 该有机物能发生水解反应,且1mol该有机物需消耗氢氧化钠2mol | |
| C. | 该有机物能与溴水发生取代反应消耗Br2 3mol | |
| D. | 该有机物既能与盐酸反应,又能与碳酸氢钠溶液反应 |
8.第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol•L-1的这四种溶液pH与该元素原子半径的关系如右图所示.下列说法正确的是( )
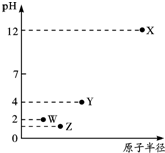

| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y元素存在同素异形体 | |
| C. | 气态氢化物的稳定性:Z>W>Y | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
15.已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
| A. | 所得溶液中的c(H+)=1.0×10-13 mol•L-1 | |
| B. | 所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol•L-1 | |
| C. | 所加的烧碱溶液的pH=13.0 | |
| D. | 所得溶液中的c(Mg2+)=5.6×10-10 mol•L-1 |
12.某烃的分子式为C11H20,1mol该烃在催化剂作用下可以吸收2mol H2;用热的酸性KMnO4溶液氧化,得到丁酮( 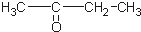 )、丙酮(
)、丙酮(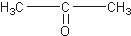 )和琥珀酸(
)和琥珀酸( )三者的混合物,该烃的结构简式为( )
)三者的混合物,该烃的结构简式为( )
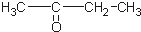 )、丙酮(
)、丙酮( )和琥珀酸(
)和琥珀酸( )三者的混合物,该烃的结构简式为( )
)三者的混合物,该烃的结构简式为( )| A. | 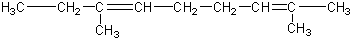 | |
| B. | 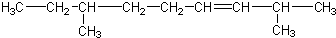 | |
| C. | 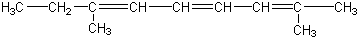 | |
| D. |  |
13.下列关于元素周期律的叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化 | |
| D. | 元素原子的核外电子排布、原子半径及元素主要化合价的都发生周期性变化 |