题目内容
5.过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂.某兴趣小组制备过碳酸钠的实验方案(图1)和装置示意图如图2: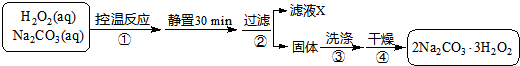 图1
图1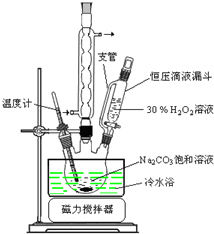
已知:主反应:2Na2CO3 (aq)+3H2O2 (aq)?2Na2CO3•3H2O2 (s)△H<0
副反应:2H2O2=2H2O+O2↑,50℃时2Na2CO3•3H2O2 (s) 开始分解
请回答下列问题:
(1)步骤①的关键是控制温度,原因是制备过碳酸钠是放热反应,防止分解,其措施有冷水浴、磁力搅拌和缓慢滴加H2O2溶液.
(2)在滤液X中加入适量NaCl固体可析出过碳酸钠,原因是增大钠离子浓度、降低产品的溶解度(盐析作用或醇析作用).
(3)步骤③中选用无水乙醇洗涤产品的目的是洗去水份,利于干燥.
(4)下列物质中,会引起过碳酸钠失效的有BD.
A.NaHCO3 B.MnO2 图2
C.Na2SiO3 D.Na2SO3
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→过滤洗涤干燥称量,需要直接测定的物理量有:样品的质量m1g、沉淀的质量m2g(用字母表示并注明其含义).产品中过碳酸钠质量分数的表达式为:$\frac{314({m}_{1}-\frac{106{m}_{2}}{197})}{102{m}_{1}}$.
分析 双氧水和碳酸钠混合控制温度发生反应2Na2CO3 (aq)+3H2O2 (aq)?2Na2CO3•3H2O2(s),静置过滤得到固体2Na2CO3•3H2O2,滤液中含有双氧水,将固体洗涤、干燥得到较纯净的2Na2CO3•3H2O2;
(1)温度过高时过碳酸钠分解导致其产率过低;反应温度较低,控制温度可迁移苯与硝酸反应的温度控制方法;还可以搅拌冷却;让反应速率减小,缓慢滴加H2O2溶液;
(2)钠离子浓度越大,碳酸钠的溶解度越小;
(3)过碳酸钠难溶于乙醇,水和乙醇互溶;
(4)过碳酸钠相当于带结晶双氧水的碳酸钠,具有双氧水的性质,催化剂、还原性物质易促进过碳酸钠反应而导致失效;
(5)沉淀法测定过碳酸钠质量分数需要称量样品质量和沉淀质量,列方程计算过碳酸钠的质量,进而计算得到过碳酸钠质量分数.
解答 解:双氧水和碳酸钠混合控制温度发生反应2Na2CO3 (aq)+3H2O2 (aq)?2Na2CO3•3H2O2(s),静置过滤得到固体2Na2CO3•3H2O2,滤液中含有双氧水,将固体洗涤、干燥得到较纯净的2Na2CO3•3H2O2;
(1)制备过碳酸钠是放热反应,反应过程中放出的热量使温度升高,温度过高会导致过碳酸钠分解,从而降低其产率;
反应温度较低,控制温度可迁移苯与硝酸反应的温度控制方法,即水浴法;搅拌也可以控制温度,所以还可用磁力搅拌的方法;让反应速率减小控制温度,所以可用缓慢滴加H2O2溶液的方法,
故答案为:制备过碳酸钠是放热反应,防止分解;冷水浴;磁力搅拌;缓慢滴加H2O2溶液;
(2)加入氯化钠固体或无水乙醇,钠离子浓度增大,降低了过碳酸钠的溶解度,故答案为:增大钠离子浓度、降低产品的溶解度(盐析作用或醇析作用);
(3)无水乙醇能和水互溶,且极易挥发,所以选用无水乙醇洗涤,所以其目的是:洗去水份,利于干燥,
故答案为:洗去水份,利于干燥;
(4)过碳酸钠相当于带结晶双氧水的碳酸钠,具有双氧水的性质,催化剂、还原性物质易促进过碳酸钠反应而导致失效,二氧化锰能作双氧水的催化剂、亚硫酸钠具有还原性,碳酸氢钠和硅酸钠都不与过碳酸钠反应,所以能引起过碳酸钠失效的是二氧化锰和亚硫酸钠,故选BD;
(5)实验过程中直接测定的物理量为样品的质量m1g、沉淀的质量m2g,沉淀物质的量=$\frac{{m}_{2}g}{197g/mol}$=$\frac{{m}_{2}}{197}$mol,设过碳酸钠物质的量为x,含有的碳酸钠物质的量为y,依据碳元素守恒得到2x+y=$\frac{{m}_{2}}{197}$,
314x+106y=m1
x=$\frac{{m}_{1}-\frac{{m}_{2}×106}{197}}{102}$;
过碳酸钠质量分数=$\frac{{m}_{1}-\frac{{m}_{2}×106}{197}}{102}$mol×314g/mol÷m1g=$\frac{314({m}_{1}-\frac{106{m}_{2}}{197})}{102{m}_{1}}$,
故答案为:样品的质量m1g、沉淀的质量m2g; $\frac{314({m}_{1}-\frac{106{m}_{2}}{197})}{102{m}_{1}}$.
点评 本题考查制备实验方案设计,侧重考查分析、计算及知识迁移、基本操作能力,难点是过碳酸钠质量分数的计算,灵活运用原子守恒解答,(4)利用知识迁移方法解答即可,题目难度中等.

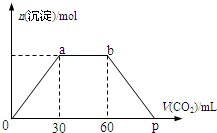 向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | 横坐标轴上p点的值为90 | |
| C. | b点时溶质为NaHCO3 | |
| D. | ab段发生反应的离子方程式依次为:CO2+2OH-→H2O+CO32-,CO2+H2O+CO32-→2HCO3- |
| A. | CH3CH2NO2 | B. | CH2═CHBr | C. | CH2Cl2 | D. |  |
| A. | 除去(NH4)2CO3溶液中含有的少量NH4HCO3杂质的方法是加入NaOH溶液 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中不能得到纯净的氯气 | |
| C. | 向两份Fe2O3的固体中分别加入HCl溶液与HI溶液,二者反应现象相同 | |
| D. | 向固体中加入足量的浓HNO3加热,能得到使澄清石灰水变浑浊的气体,证明该固体中一定存在CO32-或HCO3- |
| A. | 石油气、煤油和石蜡的主要成分都是碳氢化合物 | |
| B. | 含碳的化合物不一定都是有机物 | |
| C. | 由CH2=CH-COOCH3合成的聚合物为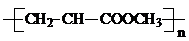 | |
| D. | 苯不具有典型双键所应具有的加成反应,故不可能发生加成反应 |
| A. | 所得溶液中的c(H+)=1.0×10-13 mol•L-1 | |
| B. | 所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol•L-1 | |
| C. | 所加的烧碱溶液的pH=13.0 | |
| D. | 所得溶液中的c(Mg2+)=5.6×10-10 mol•L-1 |
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.