题目内容
8.下列说法中正确的是( )| A. | 由Fe、Cu、FeCl3溶液组成的原电池中,负极反应式为:Cu-2e-═Cu2+ | |
| B. | 由Al、Mg、NaOH 溶液组成的原电池中,负极反应式为:Al+4OH--3e-═AlO2-+2H2O | |
| C. | 由Al、Cu、稀硫酸溶液组成的原电池中,负极反应式为:Cu-2e-═Cu2+ | |
| D. | 由Al、Cu、浓硝酸溶液组成的原电池中,负极反应式为:Al-3e-═Al3+ |
分析 A.由Fe、Cu与FeCl3溶液组成的原电池,铁易失电子作负极,铜作正极;
B.由Al、Mg与氢氧化钠溶液组成的原电池,该条件下,铝易失电子而作负极,镁作正极;
C.由Al、Cu、稀硫酸组成的原电池,铝易失电子而作负极,铜作正极;
D.由Al、Cu与浓硝酸组成的原电池,该条件下,铜易失电子而作负极,铝作正极;
负极上失电子发生氧化反应,正极上得电子发生还原反应.
解答 解:A.由Fe、Cu与FeCl3溶液组成的原电池,铁易失电子作负极,铜作正极,负极电极反应式为:Fe-2e-═Fe2+,故A错误;
B.由Al、Mg与氢氧化钠溶液组成的原电池,该条件下,铝易失电子而作负极,镁作正极,负极反应式为:Al+4OH--3e-═AlO2-+2H2O,故B正确;
C.由Al、Cu、稀硫酸组成的原电池,铝易失电子而作负极,电极反应式为:Al-3e-═Al3+,故C错误;
D.由Al、Cu与浓硝酸组成的原电池,该条件下,铜易失电子而作负极,铝作正极,负极上电极反应式为:Cu-2e-═Cu2+,故D错误;
故选:B.
点评 本题考查了原电池正负极的判断,根据电极上得失电子来判断正负极,不能根据金属的活泼性强弱来确定正负极,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.在下列反应中,光照对反应几乎没有影响的是( )
| A. | 氯气与氢气的反应 | B. | 氯气与甲烷的反应 | ||
| C. | 氟气与氢气的反应 | D. | 次氯酸的分解 |
19.x、y、z三种元素的离子具有相同的电子层结构,离子半径x>y,y与z可形成zy2型离子化合物,则3种元素的原子序数关系是( )
| A. | x>y>z | B. | y>x>z | C. | z>x>y | D. | z>y>x |
16.某原子的原子核外最外层电子排布为ns2np4,按照共用电子对理论,该原子一般可形成共用电子对的数目是( )
| A. | 1对 | B. | 2对 | C. | 3对 | D. | 4对 |
3.下列物质中既含有离子键,又含有非极性共价键的是( )
| A. | NaOH | B. | Na2O2 | C. | MgCl2 | D. | CH4 |
13.氢气在氧气中燃烧时产生淡蓝色火焰.在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol O2中的化学键消耗的能量为Q2 kJ,形成1mol H2O中的化学键释放的能量为Q3 kJ.下列关系式中,正确的是( )
| A. | Q1+Q2>Q3 | B. | 2Q1+Q2>2Q3 | C. | 2Q1+Q2<2Q3 | D. | Q1+Q2<2Q3 |
20.实验是研究化学的基础.关于各装置图的叙述中,正确的是( )
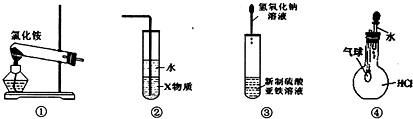

| A. | 装置①常用于实验室制取氨 | |
| B. | 装置②中X若为苯,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③可用于制备氢氧化亚铁并观察其颜色 | |
| D. | 装置④可验证HCl气体在水中的溶解性 |
17. 咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )
咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )
 咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )
咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )| A. | 咖啡酸的分子式为C9H8O4 | |
| B. | 1mol咖啡酸可以和含4molBr2的浓溴水反应 | |
| C. | 1mol咖啡酸可以和3molNaOH反应 | |
| D. | 可以用高锰酸钾检验出咖啡酸分子中含有碳碳双键 |