题目内容
20.实验是研究化学的基础.关于各装置图的叙述中,正确的是( )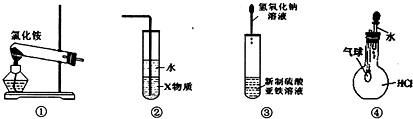
| A. | 装置①常用于实验室制取氨 | |
| B. | 装置②中X若为苯,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③可用于制备氢氧化亚铁并观察其颜色 | |
| D. | 装置④可验证HCl气体在水中的溶解性 |
分析 A.氯化铵分解后,在试管口氨气与HCl又化合生成氯化铵;
B.X若为苯,水在下层,不能隔绝气体与水;
C.氢氧化亚铁易被氧化;
D.挤压胶头滴管,HCl易溶于水,则气球变大.
解答 解:A.氯化铵分解后,在试管口氨气与HCl又化合生成氯化铵,不能制备氨气,应利用氯化铵与碱加热制取,故A错误;
B.X若为苯,水在下层,不能隔绝气体与水,则不能防止倒吸,应将X改为四氯化碳,故B错误;
C.氢氧化亚铁易被氧化,不能观察其颜色,应注意隔绝空气制取,故C错误;
D.挤压胶头滴管,HCl易溶于水,则气球变大,则图中装置可验证HCl气体在水中的溶解性,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、防倒吸及性质实验等,把握反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
10.现有4摩尔铝及足量稀HCl和稀NaOH溶液,欲将铝全部转化为Al(OH)3,所需HCl与NaOH的物质的量之和最少应是( )
| A. | 6摩尔 | B. | 4摩尔 | C. | 16摩尔 | D. | 8摩尔 |
8.下列说法中正确的是( )
| A. | 由Fe、Cu、FeCl3溶液组成的原电池中,负极反应式为:Cu-2e-═Cu2+ | |
| B. | 由Al、Mg、NaOH 溶液组成的原电池中,负极反应式为:Al+4OH--3e-═AlO2-+2H2O | |
| C. | 由Al、Cu、稀硫酸溶液组成的原电池中,负极反应式为:Cu-2e-═Cu2+ | |
| D. | 由Al、Cu、浓硝酸溶液组成的原电池中,负极反应式为:Al-3e-═Al3+ |
15.一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应;X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器气体密度不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 容器内各物质的浓度不随时间变化 | |
| D. | 单位时间消耗0.1 mol X同时生成0.2 mol Z |
12.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4LSO3含有NA个分子 | |
| B. | 6.4g氧气和3.2g臭氧(O3)混合气体所含有的氧原子数为0.6NA | |
| C. | 过氧化钠与CO2反应时,0.1mol过氧化钠转移的电子数为0.2NA | |
| D. | 标准状况下,2.24L Cl2与过量的稀FeCl2溶液反应,转移电子总数为0.1NA |
9.可以用来断定碳酸氢钠粉末中是否混有碳酸钠的实验方法是( )
| A. | 加热时有无气体放出 | |
| B. | 滴加盐酸时有无气泡放出 | |
| C. | 溶于水后,滴加氯化钙溶液有无白色沉淀生成 | |
| D. | 溶于水后,滴加澄清石灰水,有无白色沉淀生成 |
17.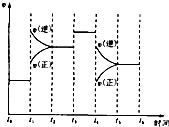 如图表示反应N2(g)+3H2(g)2NH2(g)△H<0.在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
如图表示反应N2(g)+3H2(g)2NH2(g)△H<0.在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
 如图表示反应N2(g)+3H2(g)2NH2(g)△H<0.在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
如图表示反应N2(g)+3H2(g)2NH2(g)△H<0.在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )| A. | t5~t6 | B. | t2~t3 | C. | t3~t4 | D. | t0~t1 |
 实验室通过加热氯化铵和消石灰来制取氨气.
实验室通过加热氯化铵和消石灰来制取氨气.