题目内容
13.氢气在氧气中燃烧时产生淡蓝色火焰.在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol O2中的化学键消耗的能量为Q2 kJ,形成1mol H2O中的化学键释放的能量为Q3 kJ.下列关系式中,正确的是( )| A. | Q1+Q2>Q3 | B. | 2Q1+Q2>2Q3 | C. | 2Q1+Q2<2Q3 | D. | Q1+Q2<2Q3 |
分析 化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,化学反应中的反应热△H=反应物总键能-生成物总键能,H-H键的键能为436kJ/mol,O═O键的键能为498kJ/mol,注意氢气在氧气中燃烧,反应热△H<0,每摩尔H2O中含有2molH-O键,据此计算.
解答 解:破坏1molH-H消耗的能量为Q1kJ,则H-H键能为Q1kJ/mol,破坏1molO═O键消耗的能量为Q2kJ,则O═O键键能为Q2kJ/mol,
形成1mol水中的化学键释放的能量为Q3kJ,每摩尔H2O中含有2molH-O键,1molH-O键释放的能量为$\frac{1}{2}$Q3kJ,则H-O键能为$\frac{1}{2}$Q3kJ/mol,
对于反应2H2(g)+O2(g)═2H2O(l)反应热△H=反应物的总键能-生成物的总键能,
故:反应热△H=2Q1kJ/mol+Q2kJ/mol-4×$\frac{1}{2}$Q3kJ/mol=(2Q1+Q2-2Q3)KJ/mol,
由于氢气在氧气中燃烧,反应热△H<0,即(2Q1+Q2-2Q3)<0,所以2Q1+Q2<2Q3,
故选C.
点评 本题考查反应热的计算,题目难度不大,注意从物质能量、键能角度理解反应热,明确反应热的焓变△H=反应物总键能-生成物总键能及焓变的正负与吸收、放热热量的关系.

练习册系列答案
相关题目
3.下列反应中,属于取代反应的是( )
| A. | 将苯滴入溴水中,振荡后水层接近无色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 甲烷与氯气混合,光照后黄绿色变浅 | |
| D. | 乙烯使溴的四氯化碳溶液褪色 |
4.下列有机物命名正确的是( )
| A. | 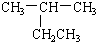 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. |  间二甲苯 间二甲苯 | D. | 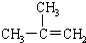 2-甲基-2-丙烯 2-甲基-2-丙烯 |
1.下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是( )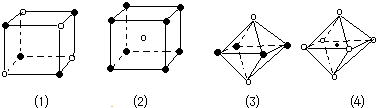

| A. | 图1和图3 | B. | 图2和图3 | C. | 图1 和图4 | D. | 只有 图1 |
8.下列说法中正确的是( )
| A. | 由Fe、Cu、FeCl3溶液组成的原电池中,负极反应式为:Cu-2e-═Cu2+ | |
| B. | 由Al、Mg、NaOH 溶液组成的原电池中,负极反应式为:Al+4OH--3e-═AlO2-+2H2O | |
| C. | 由Al、Cu、稀硫酸溶液组成的原电池中,负极反应式为:Cu-2e-═Cu2+ | |
| D. | 由Al、Cu、浓硝酸溶液组成的原电池中,负极反应式为:Al-3e-═Al3+ |
2.常温下,下列溶液中的微粒浓度关系正确的是( )
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(C1-)+c(ClO- )+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH+)>c( H2CO3) | |
| C. | pH=ll的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.2 mol•L-l CH3COOH溶液与0.1 mol•L-l NaOH溶液等体积混合:2c(H+)-2c(OH-)=C(CH3COO-)-c(CH3COOH) |
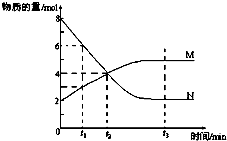 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示: M.
M. 实验室通过加热氯化铵和消石灰来制取氨气.
实验室通过加热氯化铵和消石灰来制取氨气.