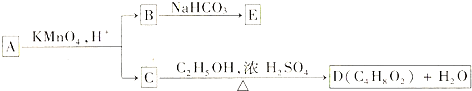题目内容
4.已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,E为黑色粉末,在如图1转化中E均起催化作用(某些产物已略去).请回答:(1)A的化学式为KClO3;B分子的电子式为
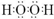 .
.(2)已知E与含A中某种元素的酸在一定条件下反应,产生一种含有该元素的气体X.某校化学兴趣小组为研究该气体的性质,设计如图2所示装置进行实验.装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.
①装入药品前,检查I中气体发生装置气密性的操作是关闭分液漏斗活塞,在II中加水,没过长导管口,用酒精灯微热圆底烧瓶,若II中有气泡冒出,停止加热后,有水进入II中的长导管,形成一段水柱,则证明I气密性良好;
②写出装置I中发生反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
③实验过程中,观察到装置IV中出现淡黄色沉淀,其主要反应的离子方程式为S2-+Cl2=S↓+2 Cl-;
④实验结束后,该组同学在装置Ⅲ中观察一b的红色褪去,但是并未观察到“a无明显变化”这一预期现象.为了达到这一实验目的,你认为在装置(选填装置序号)II和 III之间,还需添加洗气瓶,该装置的作用是除去氯气中的水蒸气(或干燥氯气);
(3)气体X能与溶液B反应,生成气体D,写出反应的化学方程式Cl2+H2O2=2HCl+O2.
分析 已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,E为黑色粉末,在如图1转化中E均起催化作用,则E应为MnO2,根据物质的状态和反应条件下可知A为KClO3,B为H2O2,都可在MnO2作催化剂的条件下生成氧气,所以D应为O2,E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X,应为MnO2与浓盐酸的反应,生成X为Cl2,结合题目的要求以及相关物质的性质解答该题.
解答 解:已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,E为黑色粉末,在如图1转化中E均起催化作用,则E应为MnO2,根据物质的状态和反应条件下可知A为KClO3,B为H2O2,都可在MnO2作催化剂的条件下生成氧气,所以D应为O2,E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X,应为MnO2与浓盐酸的反应,生成X为Cl2,
(1)由以上分析可知A为KClO3,B为H2O2,电子式为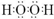 ,故答案为:KClO3;
,故答案为:KClO3;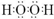 ;
;
(2)①装入药品前,检查I中气体发生装置气密性的操作是关闭分液漏斗活塞,在II中加水,没过长导管口,用酒精灯微热圆底烧瓶,若II中有气泡冒出,停止加热后,有水进入II中的长导管,形成一段水柱,则证明I气密性良好,
故答案为:关闭分液漏斗活塞,在II中加水,没过长导管口,用酒精灯微热圆底烧瓶,若II中有气泡冒出,停止加热后,有水进入II中的长导管,形成一段水柱,则证明I气密性良好;
②Ⅰ为制取氯气的发生装置,反应的方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
③实验过程中,观察到装置IV中出现淡黄色沉淀,其主要反应的离子方程式为 S2-+Cl2=S↓+2 Cl-,故答案为:S2-+Cl2=S↓+2 Cl-;
④为了观察到“a无明显变化”这一预期现象,通入Ⅲ中的氯气应为干燥后的氯气,所以应装置II和III添加盛有浓硫酸的洗气装置,用以除去氯气中的水蒸气,
故答案为:II和 III;除去氯气中的水蒸气(或干燥氯气);
(3)气体X能与溶液B反应,生成气体D,反应的化学方程式为Cl2+H2O2=2HCl+O2,故答案为:Cl2+H2O2=2HCl+O2.
点评 本题考查无机物的推断以及性质实验的探究,题目难度中等,注意根据物质的原子结构特点和反应的转化关系推断各物质的种类,为解答该题的关键,本题侧重于物质的制备和性质探究,答题时要清楚实验原理和操作步骤.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 序号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| 浓度c/mol•L-1 | 0.01 | 0.01 | 0.01 | 0.01 |
| A. | 由水电离出的c(H+):①=②=③=④ | |
| B. | 溶液的pH:②>①>④>③ | |
| C. | ②、③混合呈中性,所需溶液的体积:③>② | |
| D. | ①、④等体积混合,所得溶液中离子的浓度:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
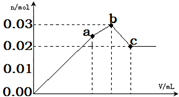 向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )
向100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法不正确的( )| A. | a点的溶液呈酸性的原因为:NH4++H2O?NH3•H2O+H+ | |
| B. | c点沉淀的质量比a点沉淀的质量大 | |
| C. | b点加入Ba(OH)2溶液的体积为150mL | |
| D. | 至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O |
| A. |  测定乙醇结构式 | B. | 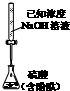 测定硫酸浓度 | ||
| C. | 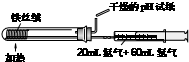 合成并检验氨 | D. | 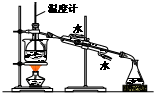 分离并回收硝基苯中的苯 |
| 选项 | 事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可作为油脂分解的催化剂 |
| B | 铝罐车可用于运输稀硝酸 | 铝表面形成致密氧化膜具有保护作用 |
| C | 甘油作为化妆品中的保湿剂 | 甘油易与水形成氢键 |
| D | 氢氟酸刻蚀水晶工艺品 | HF具有强酸性 |
| A. | A | B. | B | C. | C | D. | D |
 .
. .
. .
. .
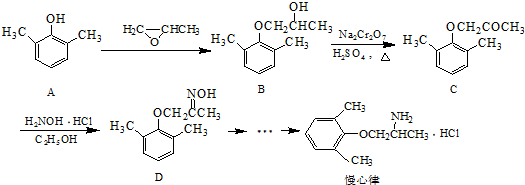
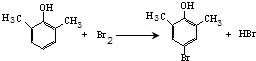
.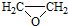 ).写出以邻甲基苯酚 (
).写出以邻甲基苯酚 (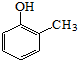 )和乙醇为原料制备
)和乙醇为原料制备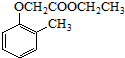 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).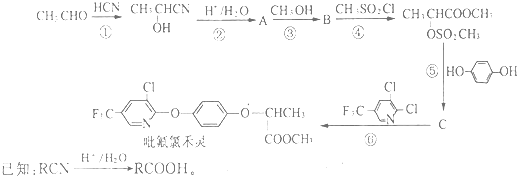
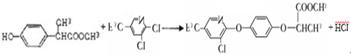 ;
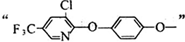
;


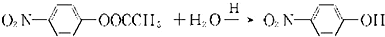 +CH3COOH.
+CH3COOH.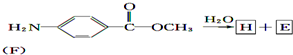
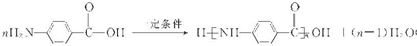 .
.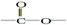 结构.
结构. .
.