题目内容
14.慢心律是一种治疗心律失常的药物,它的合成路线如下:
(1)由B→C的反应类型为氧化反应.
(2)C分子中有2个含氧官能团,分别为醚键和羰基(填官能团名称).
(3)写出A与浓溴水反应的化学方程式
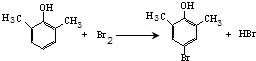 .
.(4)由A制备B的过程中有少量副产物E,它与B互为同分异构体,且苯环上取代基的数目和相对位置均相同.E的结构简式为
 .
.(5)写出同时满足下列条件的D的一种同分异构体的结构简式:
 .
.①属于α-氨基酸;②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个手性碳原子.
(6)以A的最简单同系物和HCHO为原料制备酚醛树脂的化学方程式为
 .
.(7)已知乙烯在催化剂作用与氧气反应可以生成环氧乙烷(
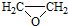 ).写出以邻甲基苯酚 (
).写出以邻甲基苯酚 (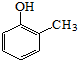 )和乙醇为原料制备
)和乙醇为原料制备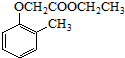 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2.
分析 (1)对比B、C结构可知,B中-CH(OH)-转化为C=O;
(2)根据C的结构简式可知,C中含氧官能官为醚键和羰基;
(3)A中含有酚羟基,酚羟基对位的苯环上有H,可与浓溴水发生取代反应;
(4)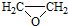 中含有2个C-O键,与A发生反应时可有两种不同的断裂方式;
中含有2个C-O键,与A发生反应时可有两种不同的断裂方式;
(5)D的一种同分异构体一种同时满足如下条件:①属于α-氨基酸,氨基、羧基连接同一碳原子上;②是苯的衍生物,且苯环上的一氯代物只有两种,可以是2个不同的取代基处于对位位置;③分子中含有两个手性碳原子,说明C原子上连接4个不同的原子或原子团;
(6)A的最简单同系物为苯酚,苯酚和HCHO发生缩聚反应得到酚醛树脂 ;
;
(7)制备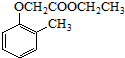 ,应先制备乙酸和
,应先制备乙酸和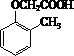 ,乙醇氧化可生成乙酸,乙醇消去可生成乙烯,乙烯氧化可生成
,乙醇氧化可生成乙酸,乙醇消去可生成乙烯,乙烯氧化可生成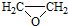 ,与
,与 反应生成
反应生成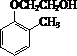 ,进而氧化可生成
,进而氧化可生成 ,再与乙醇发生酯化反应得到目标物.
,再与乙醇发生酯化反应得到目标物.
解答 解:(1)对比B、C结构可知,B中-CH(OH)-转化为C=O,属于氧化反应,故答案为:氧化反应;
(2)根据C的结构简式可知,C中含氧官能官为醚键和羰基,故答案为:醚键、羰基;
(3)A中含有酚羟基,酚羟基对位的苯环上有H,可与浓溴水发生取代反应,反应方程式为: ,
,
故答案为: ;
;
(4)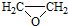 中含有2个C-O键,与A发生反应时可有两种不同的断裂方式,生成的另一种有机物的结构简式为:
中含有2个C-O键,与A发生反应时可有两种不同的断裂方式,生成的另一种有机物的结构简式为: ,
,
故答案为: ;
;
(5)D的一种同分异构体一种同时满足如下条件:①属于α-氨基酸,氨基、羧基连接同一碳原子上;②是苯的衍生物,且苯环上的一氯代物只有两种,可以是2个不同的取代基处于对位位置;③分子中含有两个手性碳原子,说明C原子上连接4个不同的原子或原子团,则满足条件的有机物的同分异构体可以为: ,
,
故答案为: ;
;
(6)A的最简单同系物为苯酚,苯酚和HCHO发生缩聚反应得到酚醛树脂,反应方程式为: ;
;
故答案为: ;
;
(7)制备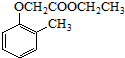 ,应先制备乙酸和
,应先制备乙酸和 ,乙醇氧化可生成乙酸,乙醇消去可生成乙烯,乙烯氧化可生成
,乙醇氧化可生成乙酸,乙醇消去可生成乙烯,乙烯氧化可生成 ,与
,与 反应生成
反应生成 ,进而氧化可生成
,进而氧化可生成 ,再与乙醇发生酯化反应得到目标物,则合成路线流程为:
,再与乙醇发生酯化反应得到目标物,则合成路线流程为: ,
,
故答案为: .
.
点评 本题考查有机物的合成、官能团结构与性质、限制条件同分异构体书写等,注意利用转化关系发生的反应类比设计合成路线,综合考查学生对知识的迁移应用、分析推理能力,难度中等.

 如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )
如图装置中,容器甲内充入0.1mol NO气体.干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积的$\frac{9}{10}$,干燥管中物质的质量增加了2.24g.随着CO2的继续通入,活塞又逐渐向右移动.下列说法中正确的是( )| A. | 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L (标准状况) | |
| B. | NO2转化为N2O4的转化率为20% | |
| C. | 容器甲中NO已反应完 | |
| D. | 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01 |
①氧化 ②还原 ③酯化 ④水解 ⑤加成 ⑥中和.
| A. | ①②③⑤ | B. | ①③④ | C. | ③④⑤ | D. | ④⑤⑥ |
| A. | 地球上CH4、CO2等气体含量上升容易导致温室效应加剧,进而引发灾难性气候 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”为不同类别的分散系 | |
| C. | 太阳光分解水制氢气、植物秸秆制沼气、高粱制乙醇都涉及到生物质能的利用 | |
| D. | PbO2具有氧化性和导电性,可用作铅蓄电池正极材料 |
| A. | 对于有气体参与的化学平衡体系,增大压强,反应速率一定加快 | |
| B. | 常温下,反应4Fe(OH)2(S)+2H2O(l)+O2(g)=4Fe(OH)3(S)的△H<0,△S<0 | |
| C. | 用0.1mol/L醋酸滴定0.lmol/L NaOH溶液至中性时:c(CH3COO -)+c(CH3COOH)<c(Na+) | |
| D. | 向纯水中加入盐类物质,有可能促进水的电离平衡,但不可能抑制水的电离 |
| A. | 加水稀释,电离平衡正向移动,溶液中n(H+)减小 | |
| B. | 加热,电离平衡正向移动,溶液中c(CH3COO-)增大 | |
| C. | 通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小 |

 ,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).
,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).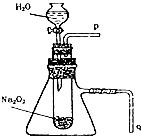 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.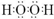 .
.