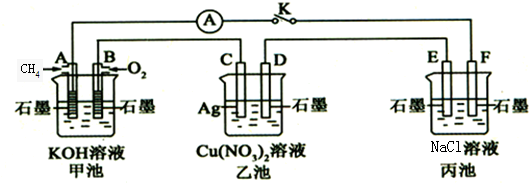
题目内容
6.下列离子方程式书写正确的是( )| A. | 向FeI2的溶液中,通入足量Cl2:2Fe2++2I-+2Cl2═I2+2Fe3++4Cl- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向水玻璃中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
分析 A.氯气足量,碘离子和亚铁离子都完全被氧化,碘离子的计量数错误;
B.铁离子能够将碘离子氧化成碘单质,漏掉了铁离子与碘离子的反应;
C.二氧化碳过量,反应生成碳酸氢钠和硅酸;
D.酸性条件下,反应产物中不能存在氢氧根离子.
解答 解:A.向FeI2的溶液中,通入足量Cl2,亚铁离子和碘离子都完全反应,正确的离子方程式为:2Fe2++4I-+3Cl2═2I2+2Fe3++6Cl-,故A错误;
B.铁离子能够氧化碘离子,正确的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故B错误;
C.向水玻璃中通入过量的CO2,反应生成硅酸和碳酸氢根离子,反应的离子方程式为:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,故C正确;
D.酸性条件下KIO3溶液与KI溶液发生反应生成I2,反应产物中不能为氢氧根离子,正确的离子方程式为:IO3-+5I-+6H+═3I2+3H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确常见的需要保留化学式的物质,如难溶物、弱电解质、氧化物等,D为易错点,注意发生反应时溶液的酸碱性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.原子结构为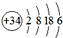 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )
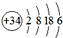 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )| A. | 第六周期第Ⅳ族 | B. | 第四周期第Ⅵ族 | C. | 第六周期第ⅣA族 | D. | 第四周期第ⅥA族 |
17.(1)在一固定容积的密闭容器中进行着如下反应:
CO2(g)+H2(g)?CO(g)+H2O(g) 其平衡常数K和温度t的关系如下:
(a)该反应平衡常数K的表达式为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;
(b)当温度为850℃,在2L密闭容器中通入1.0mol CO2和1.0mol H2,则平衡后,CO2的转化率为50%.
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.这两步的能量变化示意图如下:
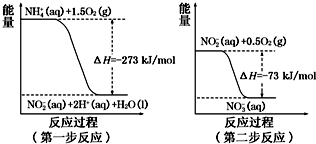
(a)第二步反应是放热反应(选填“放热”或“吸热”)
(b)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是NH4+ (aq)+2O2(g)═NO3- (aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol.
(3)已知:
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=2.0×10-2.
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-.
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40mol/L的Na2CO3溶液和0.20mol/L的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为4.96×10-8mol/L.
CO2(g)+H2(g)?CO(g)+H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(b)当温度为850℃,在2L密闭容器中通入1.0mol CO2和1.0mol H2,则平衡后,CO2的转化率为50%.
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.这两步的能量变化示意图如下:

(a)第二步反应是放热反应(选填“放热”或“吸热”)
(b)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是NH4+ (aq)+2O2(g)═NO3- (aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol.
(3)已知:
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-.
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40mol/L的Na2CO3溶液和0.20mol/L的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为4.96×10-8mol/L.
14.向硫酸铜溶液中通入足量NH3后可得到深蓝色溶液[溶质为Cu(NH3)4SO4],再向所得溶液通入SO2至溶液呈微酸性发现有白色沉淀Q生成,反应方程式为:①2Cu(NH3)4SO4+3SO2+4H2O=2NH4CuSO3↓+3(NH4)2SO4.再将Q与足量的10mol/L硫酸混合微热,则会发生如下反应:②2NH4CuSO3+2H2SO4=Cu+(NH4)2SO4+2SO2+CuSO4+2H2O.对上述两个反应的有关分析中正确的是( )
| A. | ①是非氧化还原反应,而②是氧化还原反应 | |
| B. | 上述反应中SO2的作用只相当于催化剂 | |
| C. | 反应②中CuSO4是氧化产物 | |
| D. | 反应①中SO2发生还原反应 |
11.如表是部分短周期元素原子半径及主要化合价,根据表中信息,判断以下叙述不正确的是( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的金属性逐渐减弱 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为非电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键 |
15.下列各实验中,有关浓盐酸作用的表述错误的是( )
| A. | 配制CuCl2溶液时,将CuCl2(s)溶于浓HCl后再加水冲稀,浓盐酸作用:有利于抑制CuCl2水解,可防止Cu(OH)2的形成 | |
| B. | 加热MnO2的浓HCl溶液制取氯气.浓盐酸作用:有利于减少氯气的溶解损失 | |
| C. | 浓硝酸不能溶解金,需用浓HCl溶液配制王水才能溶解金.浓盐酸作用:有利于增强Au的还原性,并且提高硝酸的氧化性 | |
| D. | 将浓硫酸滴入浓盐酸中制备HCl气体.浓盐酸作用:增大溶质的浓度,有利于促进平衡向气体溶解的逆方向移动 |
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
 .
. .
. .
.