题目内容
16.某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转.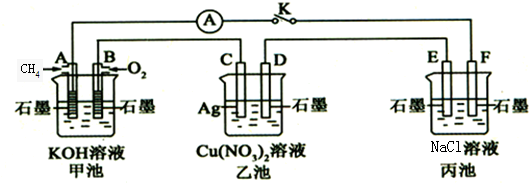
请回答下列问题:
(1)甲池中A电极的电极反应式为CH4+4OH--6e-═CO32-+6H2O.
(2)当乙池中C极质量减轻10.8g时,甲池中B电极理论上消耗O2的体积为560mL(标准状况).
(3)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是A(填选项字母).
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3.
(4)丙池中E、F电极上均有气体产生,其中F电极得到的是氢气,电解氯化钠溶液的总反应方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(5)若甲池中甲烷通入量是1L(标准状况),且完全反应,则理论上通过电路的电量为3.45×104C(法拉第常数F=9.65×104C•mol-1)
分析 (1)甲池能自发进行氧化还原反应为原电池,燃料电池中,燃料失电子发生氧化反应;
(2)根据串联电路中转移电子相等计算;
(3)根据“析出什么加入什么”的原则加入物质;
(4)F连接电源的负极,应为阴极,生成氢气,为阳极,阳极上生成氯气,电解氯化钠溶液生成氢气、氯气和氢氧化钠;
(5)由电极方程式CH4-8e-+10OH-=CO32-+7H2O,利用甲烷的量和转移电子的量之间的关系进行计算即可.
解答 解:(1)甲池能自发进行氧化还原反应为原电池,燃料电池中,燃料失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4+10OH--8e-═CO32-+7H2O,
故答案为:CH4+10OH--8e-═CO32-+7H2O;
(2)C极上的电极反应为:Ag-e-═Ag+,B电极上的电极反应为:O2+2H2O+4e-═4OH-,当池中C极质量减轻10.8g时,即转移电子是0.1mol,此时甲池中B电极理论上消耗O2的物质的量是0.025mol,体积为0.025mol×22.4L/mol=0.56L=560mL,
故答案为:560;
(3)乙池子电解硝酸铜,用活泼电极金属银为阳极,所以在阴极上是铜离子得电子生成金属铜的反应,溶液中减少了Cu元素的质量,所以要让电解质复原,需要加入金属铜,
故选:A;
(4)F连接电源的负极,应为阴极,生成氢气,为阳极,阳极上生成氯气,电解氯化钠溶液生成氢气、氯气和氢氧化钠;电解氯化钠溶液的总反应方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:氢气;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(5)由电极方程式CH4-8e-+10OH-=CO32-+7H2O可知,若电池甲烷通入量为1 L(标准状况),电解池通过的电量为$\frac{1L}{22.4L/mol}$×8×9.65×104C•mol-1=3.45×104C,故答案为:3.45×104C.
点评 本题综合考查原电池、电解池的工作原理知识,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

| A. | 向FeI2的溶液中,通入足量Cl2:2Fe2++2I-+2Cl2═I2+2Fe3++4Cl- | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向水玻璃中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
| A. | 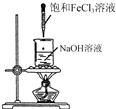 利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. | 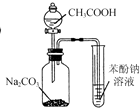 利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. |  利用图所示装置制备乙酸乙酯 |
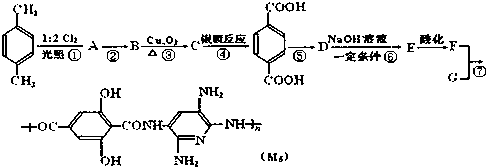
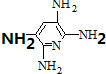 ,
, ;F的含氧官能团的名称有羧基、(酚)羟基.
;F的含氧官能团的名称有羧基、(酚)羟基.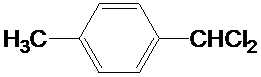 .
.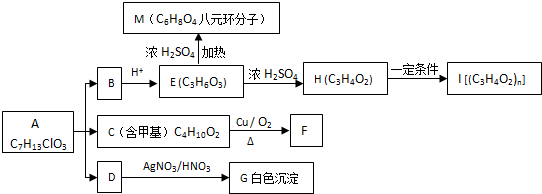
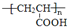
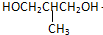 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$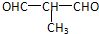 +2H2O;②E→M:2HOCH2CH2COOH $→_{△}^{浓H_{2}SO_{4}}$
+2H2O;②E→M:2HOCH2CH2COOH $→_{△}^{浓H_{2}SO_{4}}$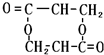 +2H2O;
+2H2O;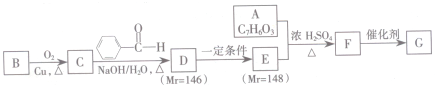
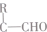
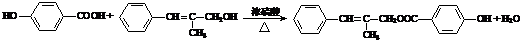 .
. .
.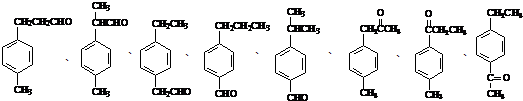 (其中任一种).
(其中任一种). 结构②苯环上有2个取代基.
结构②苯环上有2个取代基.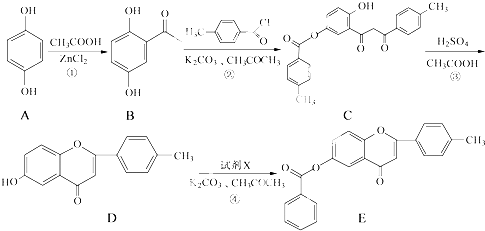
 .
.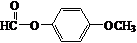 .
.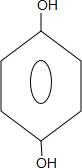 +CH3COOH$\stackrel{ZnCl_{2}}{→}$
+CH3COOH$\stackrel{ZnCl_{2}}{→}$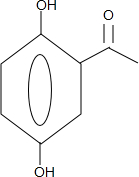 +H2O.
+H2O. .
.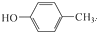 和CH3COOH为原料制备
和CH3COOH为原料制备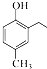 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: