题目内容
【题目】利用天然气制取合成气,然后用合成气合成多种有机物是目前部分有机物的重要来源。
I.甲烷制取合成气时,在同一容器中同时发生的主要反应是:
反应①: CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H =+206.3 kJ mol-l
CO(g)+3H2(g) △H =+206.3 kJ mol-l
反应②: CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H =-802.6 kJmol-l
CO2(g)+2H2O(g) △H =-802.6 kJmol-l
(1)下列有关合成气制取的说法中正确的是_____。
A.升温时反应①的正反应速率增大,逆反应速率减小,平衡正向移动
B.反应②因为反应物和生成物的计量数相等,所以△S=0
C.反应②放出的热可以提供反应①所需的热量
D.在恒温恒容容器中,气体密度保持不变时,反应达到化学平衡状态
(2)在制取合成气的初始阶段,反应②的反应速率大于反应①的反应速率,请用碰撞理论解释原因______。
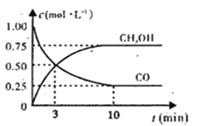
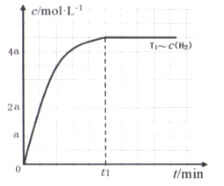
(3)在某密闭容器中加入一定量的CH4、H2O,在温度为T1时发生反应①,t1时达到化学平衡状态,氢气浓度[c(H2)]随时间(t)的变化如图。控制其它条件不变,在温度为T2时(T2<T1)发生反应,在图中画出c(CO)变化曲线_____。
II.合成己烷时发生的反应是∶
主反应:反应③6CO(g)+13H2(g)![]() C6H14(g)+6H2O(g) △H
C6H14(g)+6H2O(g) △H
副反应:反应④CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应⑤2CO(g)![]() CO2(g)+C(s)
CO2(g)+C(s)
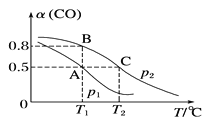
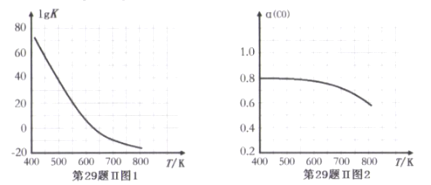
反应③的平衡常数的对数(lgK)随温度(T/K)的变化如图1,在固定的氢碳比[m(H2)/m(CO)]条件下CO的平衡转化率[a(CO)]随温度变化的曲线如图2.
请回答∶
(1)反应③的△H______0 (填“>”“="或“<")
(2) 600K前随温度升高反应③的平衡转化率几乎不变,结合图1说明原因(副反应影响可忽略)_____。
(3)工业生产需要选择适合的条件提高综合效益,下列对工业合成已烷的说法中正确的是(______)
A.减少体系中的水蒸气,有利于提高生产效益
B.在体系中加入并保持一定量的二氧化碳有利于减少副反应的发生
C.在体系中加入并保持一定量的碳有利于工业合成已烷
D.工业生产中,选择的压强越高越有利于提高综合效益
【答案】C 反应②的活化能较反应①的小,单位体积内活化分子百分数较大,有效碰撞次数较多,反应速率较快 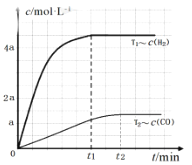 < 反应③的平衡常数K在600K前虽然随温度升高下降,但仍然很大,平衡转化率降低很小。 AB
< 反应③的平衡常数K在600K前虽然随温度升高下降,但仍然很大,平衡转化率降低很小。 AB
【解析】
从温度影响化学反应速率的角度分析。熵变等于0是混乱度不变的反应。反应②放热,反应①吸热,同一容器中同时发生反应②和反应①,反应②为反应①提供热量。根据平衡判据判断反应是否处于化学平衡状态。根据活化能的大小和单位体积活化分子百分数分析。温度降低,达到平衡的时间延长,平衡向放热的方向移动,逆向移动。根据图像中化学平衡常数随温度的变化判断反应放热还是吸热,并考虑转化率的影响。从平衡移动的方向考虑,然后分析。
I.(1) A.升温时反应①的正反应速率增大,逆反应速率也增大,正反应方向为吸热的反应,故温度升高,平衡正向移动,故A错误;
B.反应②因为反应物和生成物都是气体,气体的混乱度没有发生变化,所以△S=0,故B错误;
C.反应②和反应①在同一体系中,反应②放出的热可以提供反应①所需的热量,故C正确;
D.在恒温恒容容器中,气体密度始终不变,故不能判断反应达到化学平衡状态,故D错误;
答案选C。
(2)在制取合成气的初始阶段,反应②的活化能较反应①的小,单位体积内活化分子百分数较大,有效碰撞次数较多,反应速率较快,反应②的反应速率大于反应①的反应速率;
(3) 图中可以看出反应①在t1时刻达到化学平衡,根据反应CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H =+206.3 kJ mol-l,可知,CO和H2的浓度的变化量之比为1:3,H2和CO都是生成物,起始浓度都是0,H2的平衡浓度为4.5a,T2时CO的平衡浓度为1.5a,则T2<T1时,温度降低时,达到平衡时的时间延长,平衡逆向移动,T2时CO的平衡浓度小于1.5a, c(CO)变化曲线为:
CO(g)+3H2(g) △H =+206.3 kJ mol-l,可知,CO和H2的浓度的变化量之比为1:3,H2和CO都是生成物,起始浓度都是0,H2的平衡浓度为4.5a,T2时CO的平衡浓度为1.5a,则T2<T1时,温度降低时,达到平衡时的时间延长,平衡逆向移动,T2时CO的平衡浓度小于1.5a, c(CO)变化曲线为: ;
;
II.(1)lgK随温度的升高而降低,K值越大,平衡正反应方向进行的程度越大,在固定的氢碳比[m(H2)/m(CO)]条件下CO的平衡转化率[a(CO)]随温度的升高而降低,说明温度升高,平衡逆向移动,逆反应方向为吸热反应,反应③的△H<0;
(2) 600K前随温度升高反应③的平衡转化率几乎不变,根据图1,反应③的平衡常数K在600K前虽然随温度升高下降,但仍然很大,平衡转化率降低很小;
(3) 根据反应,主反应:反应③6CO(g)+13H2(g)![]() C6H14(g)+6H2O(g) △H
C6H14(g)+6H2O(g) △H
副反应:反应④CO(g)+ H2O(g)![]() CO2(g)+H2(g);
CO2(g)+H2(g);
A.减少体系中的水蒸气,平衡正向移动,有利于提高生产效益,故A正确;
B.在体系中加入并保持一定量的二氧化碳,会使副反应的生成物浓度增大,使平衡逆向移动,有利于减少副反应的发生,故B正确;
C.碳是固体,在体系中加入并保持一定量的碳对平衡没有影响,故C错误;
D.工业生产中,本反应正反应方向是体积减小的反应,压强越高,越有利于提高产率,选择的压强越高,对设备的要求较高,增加了成本,不一定提高综合效益,故D错误;
答案选AB。

【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。