题目内容
【题目】18.4 g 氢氧化钠和碳酸氢钠固体混合物,在密闭容器中加热到250 ℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算原混合物中碳酸氢钠的质量分数。________________
【答案】原混合物中碳酸氢钠的质量分数为45.7%
【解析】
因为是在密闭容器中进行加热,发生NaOH+NaHCO3=Na2CO3+H2O,反应存在三种情况,一是恰好完全反应,二是NaOH过量,三是NaHCO3过量,然后根据量判断出谁过量,最后计算出结果。
密闭容器中进行加热,发生NaOH+NaHCO3=Na2CO3+H2O,假设两者恰好完全反应,则固体减少的质量应是水的质量,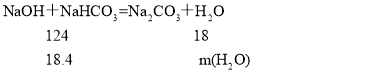 解得m(H2O)=2.7g>(18.4-16.6),因此氢氧化钠过量,碳酸氢钠完全反应,
解得m(H2O)=2.7g>(18.4-16.6),因此氢氧化钠过量,碳酸氢钠完全反应,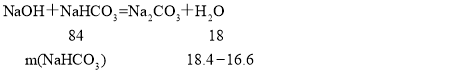 ,解得m(NaHCO3)=8.4g,则碳酸氢钠的质量分数为
,解得m(NaHCO3)=8.4g,则碳酸氢钠的质量分数为![]() ×100%=45.7%;
×100%=45.7%;
答案为45.7%。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目