题目内容
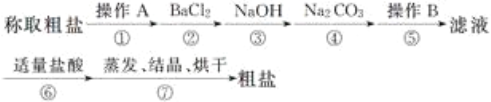
【题目】下列反应是在溶液中进行的反应,按下列要求作答:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用双线桥表示反应中电子的转移情况___;MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)该反应的氧化剂是___,发生了___反应。
(3)将其改写成离子方程式___。
(4)当有2molHCl消耗时,转移的电子的物质的量为___mol。
(5)浓盐酸在该反应中表现的性质是___(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
【答案】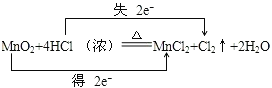 MnO2 还原 MnO2+2Cl-+4H+
MnO2 还原 MnO2+2Cl-+4H+![]() Mn2++2H2O+Cl2↑ 1 ②
Mn2++2H2O+Cl2↑ 1 ②
【解析】
反应MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑中,Mn元素化合价降低,被还原,
MnCl2+2H2O+Cl2↑中,Mn元素化合价降低,被还原,![]() 为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,
为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,![]() 为氧化产物,
为氧化产物,![]() 为还原产物,氧化剂与还原剂的物质的量之比为1:2,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为:
为还原产物,氧化剂与还原剂的物质的量之比为1:2,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: ,
,
(1)用“双线桥”标明反应中电子的转移及数目为: ;故答案为:
;故答案为:![]()
 ;
;
![]() 该反应中氧化剂为二氧化锰,发生了还原反应,故答案为:
该反应中氧化剂为二氧化锰,发生了还原反应,故答案为:![]() ;还原;
;还原;
![]() 该反应的离子方程式为:MnO2+2Cl-+4H+
该反应的离子方程式为:MnO2+2Cl-+4H+![]() Mn2++2H2O+Cl2↑;故答案为:MnO2+2Cl-+4H+
Mn2++2H2O+Cl2↑;故答案为:MnO2+2Cl-+4H+![]() Mn2++2H2O+Cl2↑;
Mn2++2H2O+Cl2↑;
![]() 当4molHCl消耗时,转移电子物质的量为2mol,则当有2molHCl消耗时转移电子物质的量为1mol;故答案为:1;
当4molHCl消耗时,转移电子物质的量为2mol,则当有2molHCl消耗时转移电子物质的量为1mol;故答案为:1;
![]() 浓盐酸在该反应中部分Cl化合价升高,体现出还原性,部分Cl化合价不变,与Mn2+形成盐,体现出酸性,则表现的性质是还原性和酸性,故②正确;故答案为:②。
浓盐酸在该反应中部分Cl化合价升高,体现出还原性,部分Cl化合价不变,与Mn2+形成盐,体现出酸性,则表现的性质是还原性和酸性,故②正确;故答案为:②。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目