题目内容
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠的途径如图所示:
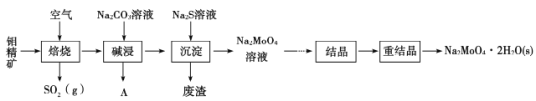
(1) Na2MoO4·2H2O中钼元素的化合价是____________
(2)焙烧过程发生的主要反应为MoS2+O2→MoO3+SO2(未配平),该反应的氧化产物是____________(填化学式)。
(3)碱浸时生成Na2MoO4和一种气体A,该气体的电子式为________;沉淀时加入Na2S溶液的目的是______________________
(4)焙烧钼精矿所用的装置是多层焙烧炉,图1为各炉层固体物料的物质的量的百分数(φ)。
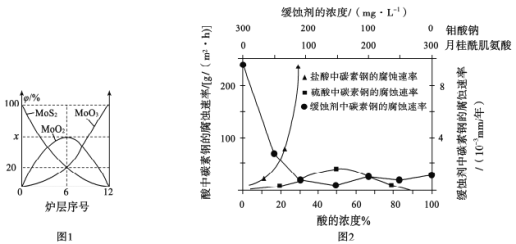
第6层焙烧炉中所得MoO3与MoO2的物质的量之比为___________
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______。
②随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是__________________________________。
③空气中钼酸盐对碳钢的缓蚀原理是在碳钢表面形成FeMnO4—Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需要加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_____________________________
【答案】+6 MoO3和SO2 ![]() 除去Pb2+离子 1:3 1:1 C1-有利于碳钢的腐蚀,SO
除去Pb2+离子 1:3 1:1 C1-有利于碳钢的腐蚀,SO![]() 不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸; 替代空气中氧气起氧化剂作用
不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸; 替代空气中氧气起氧化剂作用
【解析】
(1)~(3)从流程图知:先在空气中灼烧生成MoO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MoO3,经过“沉淀”环节除去杂质PbS,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;据此分析解答;
(4)~(6)通过读图、从图片中提取有效信息、结合元素守恒、影响速率的可能因素等知识分析、回答;
(1) 根据化合物中元素化合价代数和为0,Na2MoO4·2H2O中钼元素的化合价是+6;答案为:+6;
(2) 焙烧过程中MoS2和O2反应生成MoO3和SO2,Mo元素的化合价从+2价升高到+6价、S元素的化合价从1价升高到+4价,O元素的化合价从0价降低到2价,根据得失电子守恒和原子守恒,配平后的化学方程式为![]() ,该反应的还原剂是MoS2,则氧化产物是MoO3和SO2;
,该反应的还原剂是MoS2,则氧化产物是MoO3和SO2;
答案为:MoO3和SO2;
(3由流程图可知,碱浸时MoO3与Na2CO3反应生成一种气体A和Na2MoO4,可推知碱浸时发生了反应:![]() ,则A为CO2,电子式为
,则A为CO2,电子式为![]() ;流程图中“沉淀时”加入Na2S溶液后再过滤,得到的滤液中已经不含铅元素,则铅元素转移到废渣中,即废渣含PbS,加入Na2S溶液目的是除去Pb2+离子;
;流程图中“沉淀时”加入Na2S溶液后再过滤,得到的滤液中已经不含铅元素,则铅元素转移到废渣中,即废渣含PbS,加入Na2S溶液目的是除去Pb2+离子;
答案为:![]() ;除去Pb2+离子;
;除去Pb2+离子;
(4)第6层焙烧炉中所得含钼元素产物有与MoS2、MoO3与MoO2,其中MoS2与MoO3物质的量百分数均为20%,则MoO2物质的量百分数为60%,则MoO3与MoO2的物质的量之比为1:3;
答案为:1:3;
(5)①根据图像知当缓蚀剂中钼酸钠和月桂酰肌氨酸均为150mg/L时碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为1:1;
答案为:1:1;
②随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异,则二者主要的差别为阴离子不同,可以推测其主要原因是C1-有利于碳钢的腐蚀,SO![]() 不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;
不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;
答案为:C1-有利于碳钢的腐蚀,SO![]() 不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;
不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;
③空气中钼酸盐对碳钢的缓蚀原理是在碳钢表面形成FeMnO4—Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需要加入钼酸盐外还需加入NaNO2。则NaNO2的作用是替代空气中氧气起氧化剂作用,以便在碳钢表面形成FeMnO4—Fe2O3保护膜;
答案为:替代空气中氧气起氧化剂作用。

 中考解读考点精练系列答案
中考解读考点精练系列答案