题目内容
【题目】在工业上常用CO与H2合成甲醇,热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-574.4 kJ·mol-1。
CH3OH(g) ΔH=-574.4 kJ·mol-1。
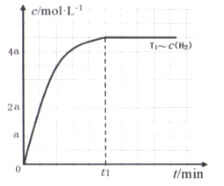
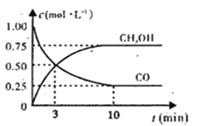
(1)下图是表示一定温度下,在体积为2L的密闭容器中加入5mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。反应第10分钟达到平衡,从反应开始到平衡,用H2表示平均反应速率v(H2)=__mol/(L·min),且反应前后体系的压强之比为____。
(2)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
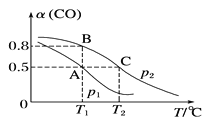
①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为__L。
【答案】0.15mol·L-1·min-1 7:4 KA=KB>KC 2
【解析】
(1)根据图1所示信息,根据v=c/t计算出v(CO)反应速率,再根据速率之比和系数成正比计算出 v(H2)反应速率;根据气体的压强之比等于气体的物质的量之比进行计算。
(2)①平衡常数与温度有关,CO与H2反应生成甲醇的反应为放热反应,据此进行分析;
②根据在同一温度下,平衡常数不变的规律,结合图给信息进行分析。
(1)由图1可知,起始时CO为的浓度为1mol/L,反应减小的CO的浓度为1mol/L-0.25mol/L=0.75mol/L,10min时达到平衡,则用CO表示的反应速率为:0.75mol/L÷10min=0.075 mol·L-1·min-1,根据速率比和系数成正比可知,用H2表示平均反应速率v(H2)=2v(CO)=2×0.075 mol·L-1·min-1= 0.15mol·L-1·min-1;由图1可知,起始时CO为的浓度为1mol/L,容器的体积为2L,n(CO)=2mol;n(H2)=5mol;反应达平衡后,n(CO)=0.25mol/L×2L=0.5mol,n(H2)=5mol-0.15mol·L-1·min-1×2L×10min=2mol;n( CH3OH )=0.75mol/L×2L=1.5mol;其它条件不变,气体的压强之比等于气体的物质的量之比,所以反应前后体系的压强之比为:(2+5):(0.5+2+1.5)=7:4;
故答案是:0.15mol·L-1·min-1 ;7:4;
(2)①平衡常数与温度有关,CO与H2反应生成甲醇的反应为放热反应,则温度升高,平衡常数减小,则KC<KA,A点与B点的温度相同,KA=KB,所以三者的关系为KA=KB>KC;
故答案是:KA=KB>KC;
②若达到平衡状态A时,容器的体积为10 L,状态A与B的平衡常数相同,状态A时CO的转化率为0.5,则平衡时CO的物质的量是10mol×(1-0.5)=5mol,浓度是0.5mol/L;c(H2)=1mol/L,生成甲醇的物质的量是5mol,浓度为0.5mol/L;所以平衡常数KA=1;设状态B时容器的体积是VL,状态B时CO的转化率是0.8,则平衡时,CO的物质的量是2/Vmol/L,氢气的物质的量浓度是4/Vmol/L,生成甲醇的物质的量浓度是8/Vmol/L,则KB=8/V÷[2/V×(4/V)2]=1,解得V=2;
答案是:2。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案