题目内容
6.下列表示式正确的是( )| A. | Cr的外围电子排布式:3d44s2 | B. | 氯化铯的晶体结构(晶胞)模型: | ||
| C. | CO2的电子式为: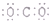 | D. | Na+的轨道表示式为: |
分析 A.3d轨道处于半满状态时比较稳定;
B.氯化铯与氯化钠都是体心立方晶体结构;
C.二氧化碳为共价化合物,分子中含有两个碳氧双键,碳原子最外层达到8电子稳定结构;
D.同一轨道中电子的自旋方向应该相反.
解答 解:A.3d44s2违背了半充满时为稳定状态,正确的电子排布式为:3d54s1,故A错误;
B.氯化铯晶胞是体心立方晶胞,配位数为8,其晶胞模型为: ,故B正确;
,故B正确;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C错误;
,故C错误;
D.钠原子的电子排布式为1s22s22p63s1,同一轨道的电子的自旋方向相反时能量最低,Na+的轨道表示式为: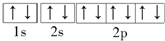 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及晶胞模型、电子排布式、轨道表示式、电子式等知识,试题知识点较多,充分考查学生的分析、理解能力及规范答题的能力,熟练掌握常见化学用语的书写原则为解答关键.

练习册系列答案
相关题目
17.截止2015年5月25日,据世界卫生组织(WHO)公布的数据显示,全球累计实验室确诊的感染MERS-CoV病例(即中东呼吸综合症,简称MERS)共1139例,其中431例死亡(病死率37.8%).这种新型冠状病毒名称定为“中东呼吸系统综合征冠状病毒”,关于此病毒下列说法正确的是( )
| A. | 该病毒主要通过血液向他人传染 | |
| B. | 该病毒在浓盐溶液中一定会发生变性 | |
| C. | 通常将病毒样本保存在福尔马林中 | |
| D. | 该病毒在一定条件下水解最终会生成氨基酸 |
14.复分解反应是中学化学中常见的一种反应类型.
请回答下列问题.
(1)已知在常温下测得浓度均为0.1mol•L-1的下列6种溶液的pH:
复分解反应在这样一个规律:一种较强酸与另一种较弱酸的盐可自发地反应,生成较弱酸
和较强酸的盐,如:2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O,若换个角度看,它同时揭示出另一条
规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质.依照该规律,请判断下列反应不能发生的是AD(填编号).
A.CO2+H2O+2NaClO→Na2CO3+2HClO
B.CO2+H2O+NaClO→NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
(2)得根据前述信息判断,常温下,浓度均为0.05mol/L的下列5种物质的溶液中,pH最小的是⑤(填编号),其pH=1(填数值);pH最大的是①(填编号)
①C6H5OH②CH3COOH③HClO4④HClO⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律,下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性的钠溶液;
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体.
请根据上述反应,总结出复分解反应的另一规律:复分解反应能向着生成更难溶物质的方向进行.
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可以观察到的现象是白色固体变为黄色,反应的离子方程式为I-+AgCl=AgI+Cl-.
请回答下列问题.
(1)已知在常温下测得浓度均为0.1mol•L-1的下列6种溶液的pH:
| 溶液 | CH3COONa | Na2CO3 | Na2CO3 | HClO | C6H5ONa |
| PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.3 |
和较强酸的盐,如:2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O,若换个角度看,它同时揭示出另一条
规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质.依照该规律,请判断下列反应不能发生的是AD(填编号).
A.CO2+H2O+2NaClO→Na2CO3+2HClO
B.CO2+H2O+NaClO→NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
(2)得根据前述信息判断,常温下,浓度均为0.05mol/L的下列5种物质的溶液中,pH最小的是⑤(填编号),其pH=1(填数值);pH最大的是①(填编号)
①C6H5OH②CH3COOH③HClO4④HClO⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律,下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性的钠溶液;
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体.
请根据上述反应,总结出复分解反应的另一规律:复分解反应能向着生成更难溶物质的方向进行.
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可以观察到的现象是白色固体变为黄色,反应的离子方程式为I-+AgCl=AgI+Cl-.
1.下列说法正确的是( )
| A. | 在CH3COONa溶液中存在CH3COOH分子,且c(CH3COOH)大于c(CH3COO-) | |||||||||||
| B. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释,c(H+)/c(HF)始终保持增大 | |||||||||||
| C. | 已知:
 的△H为-384kJ•mol-1 的△H为-384kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的氨水中加入少量NH4Cl晶体,溶液的pH不变 |
11.下列叙述正确的是( )
| A. | 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | SO2与SiO2的晶体中,化学键种类和晶体类型均相同 |
18.我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E所对应的元素符号或对应的微粒化学式作答)
(1)元素E在周期表中的位置为第四周期第IB族.
(2)写出A2D2分子的电子式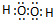 .
.
(3)A、C、D以原子个数比4:2:3形成的化合物,其水溶液的pH<7(填“>”、“<”或“=”),原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)CD3-离子的空间构型为平面三角形.B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(5)将过量C的气态氢化物通入E的硫酸盐溶液中,反应生成了一种组成较为复杂的物质,其化学式为[Cu(NH3)4]SO4,该化合物中存在的化学键类型有ABC(填字母).
A、离子键B、共价键C、配位键D、金属键.
| 元素 | 原色性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的原子轨道且各种原子轨道所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)元素E在周期表中的位置为第四周期第IB族.
(2)写出A2D2分子的电子式
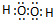 .
.(3)A、C、D以原子个数比4:2:3形成的化合物,其水溶液的pH<7(填“>”、“<”或“=”),原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)CD3-离子的空间构型为平面三角形.B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(5)将过量C的气态氢化物通入E的硫酸盐溶液中,反应生成了一种组成较为复杂的物质,其化学式为[Cu(NH3)4]SO4,该化合物中存在的化学键类型有ABC(填字母).
A、离子键B、共价键C、配位键D、金属键.
15.A、B、C、D、E是原子序数依次递增的五种元素(原子序数为5个连续的自然数),下列说法正确的是( )
| A. | B元素的最高化合价为+4价时,其负化合价也可能为-3价 | |
| B. | A(OH)n与HnEOm不能反应 | |
| C. | HnCOm为强酸时,HxDOy一定为强酸 | |
| D. | HnDOm为强酸时,E的非金属性一定很强 |
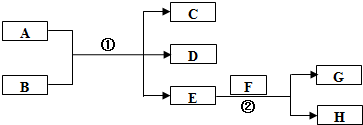
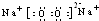 ;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.
;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.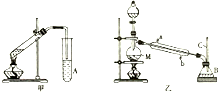 某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验.已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃.回答以下问题.
某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验.已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃.回答以下问题.