题目内容
14.复分解反应是中学化学中常见的一种反应类型.请回答下列问题.
(1)已知在常温下测得浓度均为0.1mol•L-1的下列6种溶液的pH:
| 溶液 | CH3COONa | Na2CO3 | Na2CO3 | HClO | C6H5ONa |
| PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.3 |
和较强酸的盐,如:2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O,若换个角度看,它同时揭示出另一条
规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质.依照该规律,请判断下列反应不能发生的是AD(填编号).
A.CO2+H2O+2NaClO→Na2CO3+2HClO
B.CO2+H2O+NaClO→NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
(2)得根据前述信息判断,常温下,浓度均为0.05mol/L的下列5种物质的溶液中,pH最小的是⑤(填编号),其pH=1(填数值);pH最大的是①(填编号)
①C6H5OH②CH3COOH③HClO4④HClO⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律,下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性的钠溶液;
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体.
请根据上述反应,总结出复分解反应的另一规律:复分解反应能向着生成更难溶物质的方向进行.
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可以观察到的现象是白色固体变为黄色,反应的离子方程式为I-+AgCl=AgI+Cl-.
分析 (1)根据一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,即强酸制取弱酸原理,反之也存在碱性较强的物质发生类似反应可以生成碱性较弱的物质;
(2)浓度均为0.05mol/L的六种物质的溶液,氢离子浓度越大pH越小,反之越大,强酸的电离程度大于弱酸的电离程度;
(3)根据反应有沉淀生成,结合物质的溶解度情况来分析;
(4)碘化银的溶解度小于氯化银,沉淀可以向着更难溶的方向转化.
解答 解:相同浓度的钠盐溶液,酸根离子水解程度越大,则钠盐溶液的pH越大,酸的酸性越小,根据钠盐溶液的pH知,酸性强弱顺序是:CH3COOH>H2CO3>HClO>HCN>C6H5OH,根据强酸制取弱酸判断,
A.酸性H2CO3>HClO>HCO3-,所以二氧化碳和次氯酸钠溶液反应生成碳酸氢钠,故错误;
B.酸性H2CO3>HClO>HCO3-,所以CO2+H2O+NaClO=NaHCO3+HClO成立,故正确;
C.酸性H2CO3>C6H5OH>HCO3-,应生成NaHCO3,故正确;
D.酸性H2CO3>C6H5OH>HCO3-,应生成NaHCO3,故错误;
E.酸性H2CO3>C6H5OH>HCO3-,应生成NaHCO3,故正确;
故答案为:AD;
(2)浓度均为0.05mol/L的①C6H5OH、②CH3COOH、③HClO4、④HClO、⑤H2SO4中,只有硫酸是二元强酸,电离出的氢离子浓度最大,所以酸性最强,pH最小,浓度均为0.05mol•L-1的硫酸中,c(H+)=0.1mol/L,所以pH=1,根据表中pH数据,知道HCN的酸性最弱,电离程度最小,所以氢离子浓最小,即①pH最大,
故答案为:⑤;1;①;
(3)由题意可知,三个反应都有沉淀生成,根据所给反应,总结出复分解反应发生的另一规律为:反应能够由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行,故答案为:复分解反应能向着生成更难溶物质的方向进行;
(4)KI溶液与AgCl固体混合搅拌,白色固体变为黄色,即发生反应:I-+AgCl=AgI+Cl-,证明生成了碘化银,故答案为:白色固体变为黄色;I-+AgCl=AgI+Cl-.
点评 本题考查较综合,涉及强酸制弱酸的反应规律、pH计算、沉淀转化、盐类水解的应用等,侧重反应机理探究的考查,综合性较强,题目难度中等.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案| A. | 等于(a-0.8 )g | B. | 大于(a-0.8 )g | C. | 大于(a-2.67)g | D. | 等于(a-2.67)g |
| A. | TNT的制备: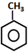 +3HNO3$→_{100℃}^{浓硫酸}$ +3HNO3$→_{100℃}^{浓硫酸}$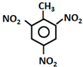 +3H2O +3H2O | |
| B. | 溴乙烷的消去反应:C2H3Br+NaOH$→_{△}^{水}$C2H4↑+NaBr+H2O | |
| C. | 乙醇氧化成乙醛:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | 乙酸乙酯在碱性条件下水解:CH3COOC2H5+H2O$?_{△}^{碱性}$CH3C0OH+C2H5OH |
| A. | 过氧乙酸与羟基丙酸(HOCH2CH2COOH)组成上相差一个CH2,故互为同系物 | |
| B. | 苯酚也能杀菌消毒,过氧乙酸与苯酚混合使用,可增强过氧乙酸的杀菌效果 | |
| C. | 由下列过氧乙酸的制取原理可以看出,过氧乙酸属于酯类有机物CH3COOH+H2O2-→CH3COOOH+H2O | |
| D. | 过氧乙酸不仅能使蛋白质变性,同时还具有漂白性,其漂白原理与双氧水相同 |
| A. | Fe3O4与稀硝酸反应:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 盐酸与醋酸钠溶液反应:H++CH3COO-═CH3COOH | |
| C. | 向FeI2溶液中通少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 向NH4Al(SO4)3溶液中加入少量氢氧化钠溶液:NH4++OH-═NH3•H2O |
| A. | Cr的外围电子排布式:3d44s2 | B. | 氯化铯的晶体结构(晶胞)模型: | ||
| C. | CO2的电子式为: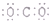 | D. | Na+的轨道表示式为: |
| A. | 给容量瓶中加水时,借助于玻璃棒,给滴定管中装液时,借助于漏斗 | |
| B. | 用梨形分液漏斗做萃取实验时,检漏该分液漏斗上口的方法与检漏容量瓶一样,检漏下方活塞的方法与检漏滴定管一样 | |
| C. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较 | |
| D. | 蒸发操作时,蒸发皿必须放在石棉网上,用酒精灯的外焰加热;水浴加热可以不用温度计 |
| 选项 | A | B | C | D |
| 正极 | Cu | Mg | C | Zn |
| 负极 | Zn | Zn | Zn | Cu |
| 电解质溶液 | H2SO4 | CuSO4 | CuCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
 .
.