题目内容
16.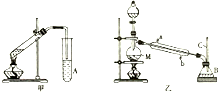 某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验.已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃.回答以下问题.
某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸(H2C=CHCOOH)与乙醇(CH3CH2OH)酯化反应的实验.已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃.回答以下问题.(1)仪器M的名称为蒸馏烧瓶,仪器A、B中的溶液均为饱和碳酸钠溶液.
(2)甲、乙两套装置中效果比较好的装置是乙,原因是乙的冷凝效果好,可减少丙烯酸乙酯的损失.
(3)乙装置中冷凝水应该从b(填“a”或“b”)口进入,长玻璃导管C的作用是冷凝回流.
(4)若7.2g丙烯酸与5.2g乙醇完全反应,则理论上生成的丙烯酸乙酯的质量为10.0g.(精确到小数点后一位)
分析 (1)由装置图可知M为蒸馏烧瓶,仪器A、B中的溶液应有利于分离酯类物质;
(2)在加热条件下进行,为减少损失,应充分冷凝;
(3)冷凝时,冷凝水应从下端进,上端出;
(4)反应方程式为H2C=CHCOOH+CH3CH2OH?H2C=CHCOOCH2CH3+H2O,结合方程式计算.
解答 解:(1)由装置图可知M为蒸馏烧瓶,因酯类物质不溶于饱和碳酸钠溶液,则吸收、提纯可用饱和碳酸钠溶液,故答案为:蒸馏烧瓶;饱和碳酸钠溶液;
(2)因反应在加热条件下进行,乙醇、丙烯酸乙酯易挥发,为减少损失,应充分冷凝,则乙装置效果较好,
故答案为:乙;乙的冷凝效果好,可减少丙烯酸乙酯的损失;
(3)乙装置中长导管C的作用是冷凝回流乙醇,平衡内外大气压强;冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,
故答案为:b;冷凝回流;
(4)n(H2C=CHCOOH)=$\frac{7.2g}{72g/mol}$=0.1mol,n(CH3CH2OH)=$\frac{5.2g}{46g/mol}$=0.113mol,
乙醇过量,如H2C=CHCOOH完全反应,则生成0.1mol丙烯酸乙酯,质量为0.1mol×100g/mol=10.0g,
故答案为:10.0g.
点评 本题考查物质的制备,侧重于学生的分析、实验以及计算能力的考查,注意把握有机物反应的特点以及常见仪器的使用,把握实验的原理和操作方法,难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
6.下列表示式正确的是( )
| A. | Cr的外围电子排布式:3d44s2 | B. | 氯化铯的晶体结构(晶胞)模型: | ||
| C. | CO2的电子式为: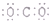 | D. | Na+的轨道表示式为: |
4.一个原电池的总反应方程式为Zn+Cu2+═Zn2++Cu,该电池可能为( )
| 选项 | A | B | C | D |
| 正极 | Cu | Mg | C | Zn |
| 负极 | Zn | Zn | Zn | Cu |
| 电解质溶液 | H2SO4 | CuSO4 | CuCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
11.山梨酸是一种常见的食物添加剂,它的结构简式为CH3-CH=CH-CH-CH-COOH,下列关于山梨酸的叙述正确的是( )
| A. | 山梨酸不能使溴水褪色 | B. | 山梨酸中的含氧官能团为羟基 | ||
| C. | 1mol山梨酸最多与2molH2加成 | D. | 山梨酸能与NaHCO3发生反应 |
1.下列叙述正确的是( )
| A. | 等质量的铝分别与足量氢氧化钠溶液和稀硝酸反应,放出的氢气一样多 | |
| B. | H2、SO2、CO2三种气体多可用浓硫酸干燥 | |
| C. | 自来水厂常用明矾对水进行消毒杀菌 | |
| D. | 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 |
8.根据下列操作现象,下属实验目的或结论正确的是( )
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 取1ml20%蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,取少量溶液,加入少量新制的Cu(OH)2,加热,没有砖红色沉淀生成 | 蔗糖没有水解 |
| B | SO2通入Ba(NO3)2溶液,生成白色沉淀 | 生成白色Ba(SO3)2沉淀 |
| C | 铜放入稀硫酸中无明显现象,再加入硝酸钠固体,有明显的气泡冒出,溶液变蓝,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向盛有3mL约5%的H2O2溶液中加入1~2滴1mol/LFeCl3溶液;有大量气泡出现,能使带火星的火柴梗复燃 | FeCl3可以催化H2O2分解的反应速率 |
| A. | A | B. | B | C. | C | D. | D |
5.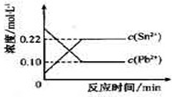 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| B. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| C. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 | |
| D. | 当溶液中固体质量不再变化时达到平衡状态 |
6.一瓶失去标签的无色溶液,下列相关说法正确的是( )
| A. | 若溶液是强酸溶液,该溶液中一定含有分子 | |
| B. | 若溶液显碱性,该溶液一定是碱溶液 | |
| C. | 无论是强酸溶液还是强碱溶液,加入金属Al一定会放出H2 | |
| D. | 向该溶液中加入酸化的BaCl2溶液,可验证是否含有SO42- |
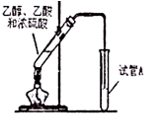 “酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯.
“酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.