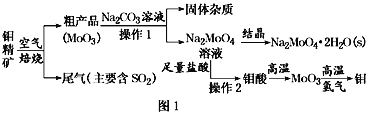
题目内容
【题目】如图表示的是可逆反应A+2B![]() 2C+3D的化学反应速率随外界条件改变(先降温后加压)而变化的情况,由此可推断出( )
2C+3D的化学反应速率随外界条件改变(先降温后加压)而变化的情况,由此可推断出( )

A.该反应的正反应是吸热反应
B.若A,B是气体,则D一定是纯液体或固体
C.该反应的平衡常数始终没变
D.A的转化率最终增大
【答案】BD
【解析】
A. 由图像可知,降低温度后,正反应速率大于逆反应速率,平衡正向移动,因此正反应为放热反应,故A不符合题意;
B. 由图像可知,增大压强后,正反应速率大于逆反应速率,平衡正向移动,而增大压强,平衡向气体体积减小的方向移动,因此正反应为气体分子数减小的反应,若A、B都是气体,则D一定是纯液体或固体,故B符合题意;
C. 由于外界条件的改变有“降低温度”,温度变化引起的平衡移动,会使得平衡常数发生变化,故C不符合题意;
D. 降温或加压过程中,平衡都正向移动,因此A的转化率都增大,故D符合题意;
故答案为:BD。

【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
请填空:
(1)反应①的K1表达式是___。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
(3)能判断反应③一定处于化学平衡状态的依据是___(填写字母序号)。
A.压强不随时间改变
B.气体密度不随时间改变
C.H2的体积分数不随时间改变
D.单位时间内生成H2和H2O(g)的物质的量相等
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
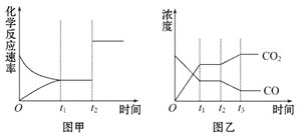
①图甲中t2时刻发生改变的条件是___。
②图乙中t2时刻发生改变的条件是__。
(5)一定条件下处于化学平衡状态的反应③当使CO2和CO的浓度同时增大为原来的两倍时,该反应的化学平衡向__移动(填“不”、“逆反应方向”或“正反应方向”)
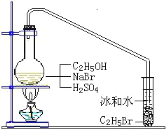
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2-3g)、适量水和少量乙醇,再加两倍于乙醇体积的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热(如图所示)。用此装置也可制备一些其它的卤代烃,如:1-溴丁烷等。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下,请回答下列问题:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/gcm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)写出该方法制备溴乙烷(C2H5Br)的化学方程式_____
(2)图中的试管放入冰水混合物的目的是_____。
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是_____。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_____;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是_____。