��Ŀ����
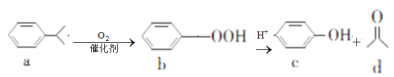
����Ŀ���������ڹ�ҵ��������������Ҫ�����á���(Mo)�ij������ϼ�Ϊ+6��+5��+4�����⾫��(��Ҫ�ɷ���MoS2)���Ʊ�������������ƾ���(Na2MoO4��2H2O)������������ͼ1��ʾ��
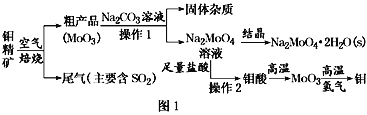
��֪����������ˮ��������Һ��Ͱ�ˮ��
�ش��������⣺
��1�������⾫��ʱ�����Ļ�ѧ����ʽΪ_____________________________��
��2���⾫����ʱ�ŷŵ�β���Ի�������ҪΣ����___________________�������һ��ʵ���ҳ�ȥ��β���ķ���____________________________________��
��3������2������Ϊ________��������õ�MoO3���õ��Ĺ����β���������������________��
��4�������⾫�����õ�װ���Ƕ�㱺��¯��ͼ2Ϊ��¯��������ϵ����ʵ����İٷ���(��)��
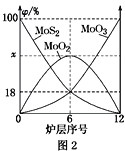
��x��________��
������¯��Ҳ�ᷢ��MoS2��MoO3��Ӧ����MoO2��SO2�ķ�Ӧ�����÷�Ӧת��6mol���ӣ������ĵ��������Ļ�ѧʽ�����ʵ����ֱ�Ϊ________��________��
��5������1�У�����̼������Һ��ַ�Ӧ���Һ��c(MoO42-)��0.80mol��L1��c(SO42-)��0.04 mol��L1���ڽᾧǰ�����Ba(OH)2�����Գ�ȥ��Һ�е�SO42-����BaMoO4��ʼ����ʱ��SO42-��ȥ������________��[Ksp(BaSO4)��1.1��1010��Ksp(BaMoO4)��4.0��108����Һ����仯�ɺ��Բ���]
���𰸡�2MoS2 + 7O2![]() 2MoO3 + 4SO2 �γ����� ���ð�ˮ������������Һ����(���������𰸾���) ���� ���� 64 MoO3 3mol 94.5%
2MoO3 + 4SO2 �γ����� ���ð�ˮ������������Һ����(���������𰸾���) ���� ���� 64 MoO3 3mol 94.5%
��������
�⾫��(��Ҫ�ɷ���MoS2)�������⾫��Ӧ�Ļ�ѧ����ʽΪ2MoS2+7O2 ![]() 2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2������Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ���õ�Na2MoO4��2H2O��Na2MoO4���������ᷴӦ�������ᣬ��������ˮ�����˵õ����ᣬ����������������MoO3�������£���������ԭMoO3�õ�Mo���ݴ˷������
2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2������Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ���õ�Na2MoO4��2H2O��Na2MoO4���������ᷴӦ�������ᣬ��������ˮ�����˵õ����ᣬ����������������MoO3�������£���������ԭMoO3�õ�Mo���ݴ˷������
(1)�⾫��(��Ҫ�ɷ���MoS2)������ʱ��MoS2����������Ӧ����MoO3ͬʱ���ɶ�������2MoS2+7O2 ![]() 2MoO3+4SO2���ʴ�Ϊ��2MoS2+7O2
2MoO3+4SO2���ʴ�Ϊ��2MoS2+7O2 ![]() 2MoO3+4SO2��
2MoO3+4SO2��
(2)�⾫����ʱ�ŷŵ�β���к��ж��������γ����ꣻ��������Ϊ������������ð�ˮ������������Һ���գ��ʴ�Ϊ���γ����ꣻ���ð�ˮ������������Һ���գ�
(3)��������ͼ������2�Ǵ�Na2MoO4�����ᷴӦ�����Һ�еõ����ᣬ��������ˮ���ù��˷���õ�����������·ֽ�õ�MoO3��Ҫ�������н��У��ʴ�Ϊ�����ˣ�������
(4)����ͼ2��֪���ڵ�6¯���д��ڵĹ������ʷֱ�ΪMoS2��MoO3��MoO2������MoS2��MoO3�����ʵ����ٷֱȾ�Ϊ18%������MoԪ���غ㣬��MoO2 �����ʵ����ٷֱ�Ϊ1-18%-18%=64%����xΪ64���ʴ�Ϊ��64��
��MoS2��MoO3��Ӧ����MoO2��SO2�ķ�ӦΪ��MoS2+6MoO3 ![]() 7MoO2+2SO2������MoS2��MoԪ�ػ��ϼ۲��䣬SԪ����-2���ߵ�+4�ۣ�������������ԭ����MoO3��MoԪ�ػ��ϼ���+6�۽��͵�+4�ۣ�����ԭ������������6mol������MoO3��Ӧת�Ƶ���12mol�����÷�Ӧת��6mol���ӣ������ĵ�MoO33mol���ʴ�Ϊ��MoO3��3mol��
7MoO2+2SO2������MoS2��MoԪ�ػ��ϼ۲��䣬SԪ����-2���ߵ�+4�ۣ�������������ԭ����MoO3��MoԪ�ػ��ϼ���+6�۽��͵�+4�ۣ�����ԭ������������6mol������MoO3��Ӧת�Ƶ���12mol�����÷�Ӧת��6mol���ӣ������ĵ�MoO33mol���ʴ�Ϊ��MoO3��3mol��
(5)c(MoO42-)=0.80molL-1��c(SO42-)=0.04molL-1����BaMoO4��ʼ����ʱ��c(Ba2+)=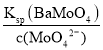 =
=![]() molL-1=5.0��10-8molL-1����ʱc(SO42-)=
molL-1=5.0��10-8molL-1����ʱc(SO42-)=![]() molL-1=2.2��10-3molL-1��SO42-��ȥ����=
molL-1=2.2��10-3molL-1��SO42-��ȥ����=![]() ��100%=94.5%���ʴ�Ϊ��94.5%��
��100%=94.5%���ʴ�Ϊ��94.5%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�