��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣�����ÿһ��ŷֱ����һ��Ԫ�ء�
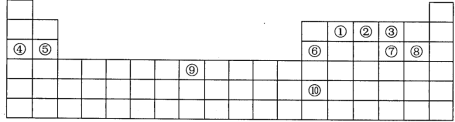
��1��Ԫ�آ�Ԫ��������__��Ԫ�آ�λ��Ԫ�����ڱ�__����
��2��Ԫ�آ�ԭ�ӵļ۵�������__��Ԫ�آ���Ԫ�����ڱ��ĵ������ڵ�__�塣
��3����Ԫ�آ١��ڡ����У��ǽ�������ǿ����__��������Ӧ��Ԫ�ط��ű�ʾ����ͬ������һ������������__��Ԫ�آۡ��ߡ���ļ����ӵİ뾶�ɴ�С��˳��Ϊ__��������ţ���Ҫ���κ����ӷ��ţ���
��4��Ԫ�آ�ĵ��ʿ��ܾ��е�������__������ĸ����
a���ܵ��絼�� b������ϡ���ᷴӦ�������� c���侧�������Ӿ���
��5����Ԫ�آܡ��ݡ�������������У��������Ե���__���ѧʽ����
��Ԫ�آ١��������������ˮ�����У�������ǿ����__���ѧʽ����
��6��Ԫ�آ�ԭ�ӵ���Χ�����Ų�Ϊ__��
���𰸡��� s 4 �� O N �ߢ�� ab Al2O3 HClO4 3d64s2
��������
����������ʮ��Ԫ�طֱ��ǣ�C��N��O��Na��Mg��Al��S��Cl��Fe��In���ݴ˼�Ԫ�ص����ʻش�
��1��Ԫ�آ�Ԫ�������������ݼ�Mg������Χ���ӹ���Ϊ3S2��λ��Ԫ�����ڱ�s��,�ʴ�Ϊ������s��
��2��Ԫ�آ�ΪC������Χ���ӹ���Ϊ2S22p2,�۵�������4��Ԫ�آ���λ��Ԫ�����ڱ��ĵ������ڵڢ��壬�ʴ�Ϊ��4������
��3��Ԫ�آ١��ڡ��۷ֱ�ΪC��N��O���ǽ�������ǿ����O����һ������������N��Ԫ�آۡ��ߡ���ֱ�ΪO��S��Cl���������У������ӡ���������18�����ӣ����Ӳ�ṹ��ͬ���˵����Խ�����Ӱ뾶ԽС�����������Ӱ뾶���������Ӱ뾶����������ʮ�����ӣ��������٣��뾶���С�������Ӱ뾶�ɴ�С��˳��Ϊ�ߢ�ۣ��ʴ�Ϊ��O��N���ߢ��
��4��Ԫ�آ���Alλ��ͬһ���壬�䵥�ʻ�ѧ���ʺ������ƣ����ǽ����Ա���ǿ���侧�������ǽ������壬����ܾ��е�������ab���ʴ�Ϊab��
��5��Ԫ�آܡ��ݡ���Na��Mg��Al������������о������Ե������������ʴ�Ϊ��Al2O3����Ԫ�آ١��������������ˮ�����У�������ǿ����HClO4����Ϊ����ǽ�������ǿ������Ԫ�أ�
��6��Ԫ�آ�Ϊ26�ŵ�������ԭ�ӵ���Χ�����Ų�Ϊ3d64s2���ʴ�Ϊ��HClO4��3d64s2��

����Ŀ������ʵ�鲻�ܴﵽԤ��Ŀ���ǣ�������
ʵ����� | ʵ��Ŀ�� | |
A | ����NO2���ܱղ�����ֱ�������䡢��ˮ�� | �о��¶ȶԻ�ѧƽ���ƶ���Ӱ�� |
B | ��ʢ��1mL��������Һ���Թ��еμ�NaCl��Һ���������г������������еμ�Na2S��Һ | ˵��һ�ֳ�����ת��Ϊ��һ���ܽ�ȸ�С�ij��� |
C | ���Ӻ�ˮ����Һ�У�������Ũ̼������Һ | �Ƚϱ�����̼�����Ƶ����� |
D | ȡ������Һ�μ�Ca��OH��2��Һ���۲��Ƿ���ְ�ɫ���� | ȷ��NaHCO3��Һ���Ƿ����Na2CO3 |
A.AB.BC.CD.D