题目内容
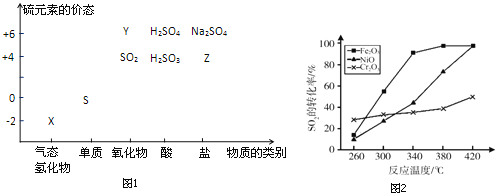
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.
完成下列填空:
(1)图中X的电子式为__;其水溶液在空气中放置易变浑浊,写出反应的化学方程式__;该变化说明S的非金属性比O__(填“强”或“弱”),从原子结构的角度解释原因:__.通过__(举两例),也可以判断氧、硫两种元素的非金属性强弱.
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是__(选填编号).
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
(3)已知反应:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O,研究其反应速率时,下列方案合理的是__(选填编号).
a 测定一段时间内生成SO2的体积,得出该反应的速率
b 研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c 用Na2S2O3固体分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
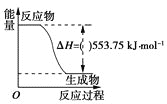
(4)治理含CO、SO2的烟道气,以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式__.
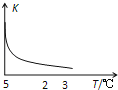
(5)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是__.
【答案】![]()
![]() 弱 硫原子半径大于氧原子,硫原子得电子能力小于氧原子 H2O的稳定性大于H2S或SO2中硫显正价,氧显负价 bd b 2CO(g)+SO2(g)
弱 硫原子半径大于氧原子,硫原子得电子能力小于氧原子 H2O的稳定性大于H2S或SO2中硫显正价,氧显负价 bd b 2CO(g)+SO2(g)![]() S(l)+2CO2 (g)△H=﹣270kJ/mol Fe2O3作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,且能耗小
S(l)+2CO2 (g)△H=﹣270kJ/mol Fe2O3作催化剂,在相对较低温度下,单位时间内获得较高的SO2转化率,且能耗小
【解析】
(1)X是-2价硫的气态氢化物,即硫化氢,其电子式为![]() ,-2价的硫具有很强的还原性,因此久置在空气中会被氧气氧化得到单质硫,反应方程式为
,-2价的硫具有很强的还原性,因此久置在空气中会被氧气氧化得到单质硫,反应方程式为![]() ,相当于非金属间的置换反应,因此氧的非金属性强于硫,这也可以从结构上看出:氧和硫同主族不同周期,硫的半径比氧大,因此得电子能力相对较弱。除此以外还可从氢化物的稳定性、互化物的化合价等方面来判断;
,相当于非金属间的置换反应,因此氧的非金属性强于硫,这也可以从结构上看出:氧和硫同主族不同周期,硫的半径比氧大,因此得电子能力相对较弱。除此以外还可从氢化物的稳定性、互化物的化合价等方面来判断;
(2)我们可以近似认为![]() 中每个硫为+2价,再来看选项:
中每个硫为+2价,再来看选项:
a.0价和-2价的硫不可能反应得到+2价,a项错误;
b.+4价和0价的硫,可能发生归中反应得到+2价,b项正确;
c.+4价和+6价的硫,不可能反应得到+2价,c项错误;
d.-2价和+4价的硫,可能发生归中反应得到+2价,d项正确,
答案选bd;
(3)a.二氧化硫会部分溶解在水中,导致实际测得的体积偏小,a项错误;
b.反应速率越快,溶液中就越快出现硫的浑浊,因此可以用来探究反应速率,b项正确;
c.浓硫酸氧化性较强,和稀硫酸的反应产物不一样,不同的反应本身速率就不同,c项错误;
答案选b;
(4)![]() 被还原为单质硫,则
被还原为单质硫,则![]() 被氧化,结合其氧化产物是一种无毒气体,推测为
被氧化,结合其氧化产物是一种无毒气体,推测为![]() ,注意在题目给的温度下硫是液体,据此写出热化学方程式:
,注意在题目给的温度下硫是液体,据此写出热化学方程式: ;
;
(5)根据图2我们发现,![]() 能在较低的温度下获得较高的转化率,因此效率最高,同时可以节约能耗。
能在较低的温度下获得较高的转化率,因此效率最高,同时可以节约能耗。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】下列实验不能达到预期目的是( )
实验操作 | 实验目的 | |
A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 苯酚和水的浊液中,加少量浓碳酸钠溶液 | 比较苯酚与碳酸氢钠的酸性 |
D | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 | 确定NaHCO3溶液中是否混有Na2CO3 |
A.AB.BC.CD.D