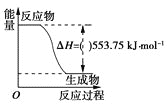
题目内容
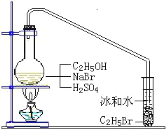
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2-3g)、适量水和少量乙醇,再加两倍于乙醇体积的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热(如图所示)。用此装置也可制备一些其它的卤代烃,如:1-溴丁烷等。可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下,请回答下列问题:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/gcm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)写出该方法制备溴乙烷(C2H5Br)的化学方程式_____
(2)图中的试管放入冰水混合物的目的是_____。
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是_____。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_____;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是_____。
【答案】C2H5OH+NaBr+H2SO4(浓)→ NaHSO4+C2H5Br+H2O 冷却、分离除杂 ab c 提高乙醇的利用率 1-溴丁烷与正丁醇的沸点接近
【解析】
制备溴乙烷(C2H5Br)时,浓硫酸先与NaBr反应,生成NaHSO4和HBr,HBr再与C2H5OH反应生成C2H5Br和H2O。由于浓硫酸具有强氧化性,而HBr又具有还原性,容易被浓硫酸进一步氧化为Br2,所以采用1:1的硫酸。溴乙烷的沸点在几种有机物中最低,所以可加热将其蒸出,从而提高乙醇的转化率;蒸出的溴乙烷蒸气需用冰水冷却,否则会随空气逸出,不仅造成浪费,还会污染空气。
(1)该方法中,C2H5OH、NaBr、H2SO4(浓)三者发生反应,生成溴乙烷等,化学方程式为C2H5OH+NaBr+H2SO4(浓)→NaHSO4+C2H5Br+H2O。答案为:C2H5OH+NaBr+H2SO4(浓)→NaHSO4+C2H5Br+H2O;
(2)为防溴乙烷挥发,收集溴乙烷的试管放入冰水混合物,目的是冷却、分离除杂。答案为:冷却、分离除杂;
(3)a.乙醇在浓硫酸的作用下,可以生成乙烯,也可生成乙醚,a符合题意;
b.浓硫酸能将溴化钠氧化,生成Br2,b符合题意;
c.浓硫酸与溴化钠反应生成HBr,与乙醇反应,加热会造成HBr的挥发,浓硫酸与HBr的挥发没有必然联系,c不合题意;
d.此反应为可逆反应,水对此反应不起催化作用,d不合题意;答案为:ab;
(4)a.NaI与Br2反应,生成NaBr和I2,I2溶解在溴代烷中,a不合题意;
b.NaOH不仅能吸收Br2,还会造成溴代烷的水解,b不合题意;
c.NaHSO3溶液能吸收Br2,生成Na2SO4、HBr等,c符合题意;
d.KCl与Br2不发生反应,不能吸收Br2,d不合题意;答案为:c;
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,有利于反应物不断转化为生成物,提高乙醇的利用率;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点接近。答案为:提高乙醇的利用率;1-溴丁烷与正丁醇的沸点接近。