题目内容
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973K和1173K的情况下,K1、K2的值分别如下:
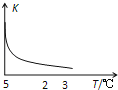
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
请填空:
(1)反应①的K1表达式是___。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
CO(g)+H2O(g),该反应的平衡常数K3,根据反应①与②可推导出K1、K2与K3之间的关系式为__,据此关系式及上表数据,能推断出反应③是__(填“吸热”或“放热”)反应。
(3)能判断反应③一定处于化学平衡状态的依据是___(填写字母序号)。
A.压强不随时间改变
B.气体密度不随时间改变
C.H2的体积分数不随时间改变
D.单位时间内生成H2和H2O(g)的物质的量相等
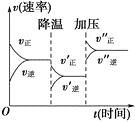
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
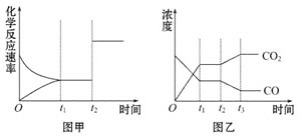
①图甲中t2时刻发生改变的条件是___。
②图乙中t2时刻发生改变的条件是__。
(5)一定条件下处于化学平衡状态的反应③当使CO2和CO的浓度同时增大为原来的两倍时,该反应的化学平衡向__移动(填“不”、“逆反应方向”或“正反应方向”)
【答案】![]()
![]() 吸热 CD 增大压强或使用催化剂 降低温度 不
吸热 CD 增大压强或使用催化剂 降低温度 不
【解析】
⑴反应①得出平衡常数。
⑵方程式相减,平衡常数相除;由表格数据可知,当温度升高时,K1增大,K2减小,故温度升高时,K 3增大,说明温度升高,平衡正向移动,因此正反应为吸热反应。
⑶A. 该反应在反应前后气体分子数不变,因此反应过程中压强一直不变,则压强不随时间变化,不能说明正逆反应速率相等,因此不能判断处于平衡状态;B. 该反应中反应物和生成物都是气体,根据质量守恒定律可得,反应过程中混合气体的质量保持不变,由于反应前后气体分子数不变,因此反应过程中混合气体的体积不变,故反应过程中,混合气体的密度一直不变,则密度不变,不能体现正逆反应速率相等,因此不能判断反应处于平衡状态;C. 反应过程中,H2的体积分数发生变化,当其不变时,说明反应达到平衡状态;D. 生成H2为逆反应,生成H2O(g)为正反应,若单位时间内生成H2和H2O(g)的物质的量相等,说明正逆反应速率相等,反应达到平衡状态。
⑷①图甲t2时,正逆反应速率同等程度增大,平衡不移动,则改变的条件为加入催化剂;由于反应③在反应前后气体分子数不变,因此增大压强,平衡不移动;②图乙t2时,c(CO2)增大,c(CO)减小,平衡逆向移动,由于该反应为吸热反应,因此改变的条件为降低温度。
⑸反应③为气体分子数不变的反应,因此同时增大CO2和CO的浓度为原来的两倍时,化学平衡不移动。
⑴反应①的平衡常数![]() ;
;
⑵反应③的平衡常数![]() ,反应②的化学平衡常数
,反应②的化学平衡常数![]() ,因此反应③的平衡常数
,因此反应③的平衡常数![]() ;由表格数据可知,当温度升高时,K1增大,K 2减小,故温度升高时,K 3增大,说明温度升高,平衡正向移动,因此正反应为吸热反应;故答案为:
;由表格数据可知,当温度升高时,K1增大,K 2减小,故温度升高时,K 3增大,说明温度升高,平衡正向移动,因此正反应为吸热反应;故答案为:![]() ;吸热。
;吸热。
⑶A. 该反应在反应前后气体分子数不变,因此反应过程中压强一直不变,则压强不随时间变化,不能说明正逆反应速率相等,因此不能判断处于平衡状态,故A不符合题意;B. 该反应中反应物和生成物都是气体,根据质量守恒定律可得,反应过程中混合气体的质量保持不变,由于反应前后气体分子数不变,因此反应过程中混合气体的体积不变,故反应过程中,混合气体的密度一直不变,则密度不变,不能体现正逆反应速率相等,因此不能判断反应处于平衡状态,故B不符合题意;C. 反应过程中,H2的体积分数发生变化,当其不变时,说明反应达到平衡状态,故C符合题意;D. 生成H2为逆反应,生成H2O(g)为正反应,若单位时间内生成H2和H2O(g)的物质的量相等,说明正逆反应速率相等,反应达到平衡状态,故D符合题意;综上所述,答案为CD。
⑷①图甲t2时,正逆反应速率同等程度增大,平衡不移动,则改变的条件为加入催化剂;由于反应③在反应前后气体分子数不变,因此增大压强,平衡不移动;故t2时刻改变的条件为增大压强或加入催化剂;故答案为:增大压强或使用催化剂。
②图乙t2时,c(CO2)增大,c(CO)减小,平衡逆向移动,由于该反应为吸热反应,因此改变的条件为降低温度;故答案为:降低温度。
⑸反应③为气体分子数不变的反应,因此同时增大CO2和CO的浓度为原来的两倍时,化学平衡不移动;故答案为:不。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:
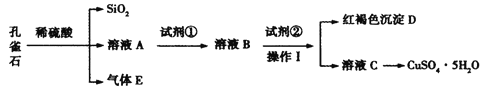
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:___(写一种)。
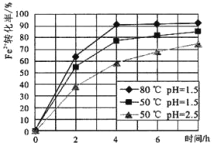
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是___。根据如图有关数据,你认为工业上氧化操作时应采取的条件是___。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___范围。操作Ⅰ的名称是___。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是___、___、过滤、洗涤、干燥。