题目内容
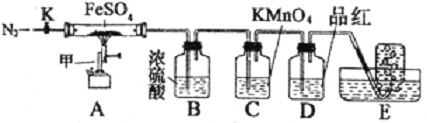
【题目】下图为铜丝与浓硫酸反应并验证其产物性质的实验装置。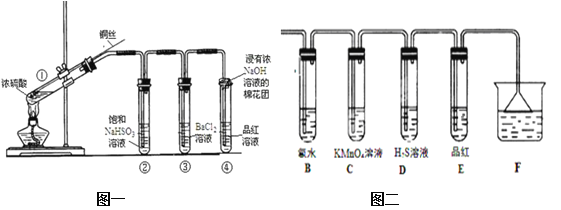
(1)①中反应的化学方程式是 。其中铜发生了 (填“氧化”或“还原”)反应,判断依据为 _______________ 。
(2)浓硫酸在此反应中体现了_________性和____________性。
(3)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。想要立即终止铜与硫酸的反应,最恰当的方法是 _____________。
a.上移铜丝,使其脱离硫酸 b.撤去酒精灯 c.拔去橡胶塞倒出硫酸
(4)反应停止后,待装置冷却,向③中溶液加入NaOH溶液,观察到的现象是__________。
(5)④中棉花团的作用是 ____ 。
(6)若将浓硫酸与铜反应后产生的气体通入图二的装置中则反应后,装置B中发生的现象是 ,反应的化学方程式为 ______________________;装置C中的现象是 ,表现了SO2的 性;装置D中现象是 ,表现了SO2的 性。
【答案】(1)Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ 氧化 溶液颜色变成蓝绿色
CuSO4+2H2O+SO2↑ 氧化 溶液颜色变成蓝绿色
(2)氧化性 酸性 (3) a (4)白色沉淀 (5)吸收二氧化硫尾气
(6)黄绿色溶液颜色褪成无色 SO2+Cl2+2H2O=H2SO4 +2HCl
溶液紫色褪去 还原性 有黄色沉淀产生(或溶液变黄色浑浊) 氧化性
【解析】
试题分析:(1)①中是浓硫酸和铜的反应,化学方程式是Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑。其中铜元素化合价升高,发生了氧化反应。由于铜离子在溶液中显蓝色,则判断依据为溶液颜色变成蓝绿色。
CuSO4+2H2O+SO2↑。其中铜元素化合价升高,发生了氧化反应。由于铜离子在溶液中显蓝色,则判断依据为溶液颜色变成蓝绿色。
(2)反应中有硫酸铜和二氧化硫生成,则浓硫酸在此反应中体现了氧化性和酸性。
(3)②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸。加热一段时间后,③中溶液依然澄清,④中溶液褪色。想要立即终止铜与硫酸的反应,最恰当的方法是上移铜丝,使其脱离硫酸,答案选a。
(4)反应停止后,待装置冷却,向③中溶液加入NaOH溶液,铜离子结合氢氧根转化为氢氧化铜,则观察到的现象是白色沉淀。
(5)二氧化硫有毒,因此④中棉花团的作用是吸收二氧化硫尾气,防止污染空气。
(6)氯气具有强氧化性,因此若将浓硫酸与铜反应后产生的气体通入图二的装置中则反应后,装置B中发生的现象是黄绿色溶液颜色褪成无色,反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl;二氧化硫能被酸性高锰酸钾溶液氧化,则装置C中的现象是溶液紫色褪去,表现了SO2的还原性;硫化氢能被二氧化硫氧化,则装置D中现象是有黄色沉淀产生(或溶液变黄色浑浊),表现了SO2的氧化性。
溶液 | 石蕊试液 | 加有酚酞的 NaOH溶液 | 酸性KMnO4 溶液 | 溴水 | 品红溶液 | 氢硫酸 (H2S溶液) |
现象 | 变红 | 褪色 | 褪色 | 褪色 | 褪色 | 生成浅黄色沉淀 |
SO2的性质 | 溶于水显酸性 | 溶于水显酸性 | 还原性 | 还原性 | 漂白性 | 氧化性 |

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 和E同主族 |
C | lmo1C单质能与冷水反应,在标准状况下生成11.2LH2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1) A在周期表中的位置为 。
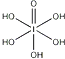
(2)B和C形成的化合物的电子式为 。
(3)B和D简单离子的半径大小为 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是 (填序号)。
A.比较两种单质的颜色
B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置
D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的化学式为 。