��Ŀ����
����Ŀ��������������(FeSO4�� 7H2O)�׳��̷������������»�ֽ⡣ij��ѧ�о�С����������װ��̽��FeSO4�ֽ��IJ��
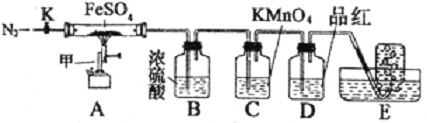
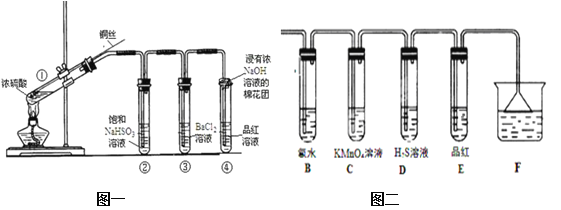
ʵ�鲽����
��ͼ��װ������(��ʡ�Լг�����)�����װ�õ������ԣ�ȷ��ȡmgFeSO4��������Ӳ�ʲ������У���E�еĵ��ܳ���ˮ�ۣ�����K��ͨ��һ��ʱ���N2���رջ���K������A�еIJ�����һ��ʱ���E�е�������ˮ������ƿ���ռ����������ô����ǵ�ľ������E�����ռ������壬�����ǵ�ľ���ܹ���ȼ����A�й��岻�ٷ����ֹͣ���ȣ���K������ͨ�뵪������������ȴ���õ�����ɫ��ĩ����ش�����������
��1��������������__________��
��2��B��Ũ���������__________��
��3��ʵ������з���C����Һ��ɫ��dz��D�������Ա仯��д��C�з�����Ӧ�����ӷ���ʽ__________��
��4�� FeSO4��ȫ�ֽ����Ҫͨ��һ��ʱ��N2��ԭ����__________��
��5����C��ԭ�ȼ�����20mL 1.00mol/L��KMnO4��Һ��Ϊ��ȷ��FeSO4�ֽ�Ļ�ѧ����ʽ��ijͬѧ����������ʵ����
��������Bװ����ʵ��ǰ������ 0.80g��
������ʵ���C�е���Һȫ��ת����100mL����ƿ�У�����ˮϡ�����̶��ߣ�
����ȷ��ȡ20.00mL��Һ����ƿ�У���������ϡ�����ữ����0.20mo1/L��H2C2O4��Һ�ζ����յ���
�����ظ�ʵ��3��.��¼����������
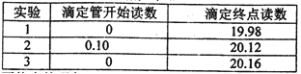
���ζ����յ������__________��
��FeSO4�ֽ�Ļ�ѧ����ʽΪ__________��
��6�������һ��ʵ��������A�е�FeSO4�Ƿ���ȫ�ֽ�__________��
���𰸡���1���ƾ���ƣ�
��2�����շֽ������SO3��
��3��5SO2+2MnO4��+2H2O=5SO42��+2Mn2++4H+
��4����װ���ڲ�����������������װ������ȫ���գ�ͬʱ��ֹ����������
��5������Һ��dz��ɫ(��dz��ɫ)�����ɫ���Ұ���Ӳ��ָ���dz��ɫ��
��8FeSO4![]() 4Fe2O3+ 6SO2��+ 2SO3��+ O2��
4Fe2O3+ 6SO2��+ 2SO3��+ O2��
��6������Ӧ��Ĺ���ת����С�ձ��У���������ˮ�����裬���ˣ�ȡ������Һ���Թ��У����뼸��K3[Fe(CN)6]��Һ��������������ɫ������˵��FeSO4û����ȫ�ֽ⣬��֮��ֽ���ȫ��(���������𰸾���)
��������
�����������1��������Ϊ�ƾ���ƣ��ʴ�Ϊ���ƾ���ƣ�
��2�����������ֽ����ɶ�������������������������B��Ũ�����������շֽ�������SO3���ʴ�Ϊ�����շֽ������SO3��
��3������������л�ԭ�ԣ��ܹ����������������C�з�����Ӧ�����ӷ���ʽΪ5SO2+2MnO4��+2H2O=5SO42��+2Mn2++4H+���ʴ�Ϊ��5SO2+2MnO4��+2H2O=5SO42��+2Mn2++4H+��
��4�� FeSO4��ȫ�ֽ������ͨ��һ��ʱ��N2��������װ���ڲ�����������������װ������ȫ���գ�ͬʱ��ֹ�����������ʴ�Ϊ����װ���ڲ�����������������װ������ȫ���գ�ͬʱ��ֹ����������
��5�������������Һ����ɫ���ζ��յ�������Ϊ��Һ��dz��ɫ(��dz��ɫ)�����ɫ���Ұ���Ӳ��ָ���dz��ɫ���ʴ�Ϊ����Һ��dz��ɫ(��dz��ɫ)�����ɫ���Ұ���Ӳ��ָ���dz��ɫ��
��E���ռ������壬�ܹ�ʹ�����ǵ�ľ����ȼ��˵����������������FeSO4�ֽ�Ļ�ѧ����ʽΪ8FeSO4![]() 4Fe2O3+ 6SO2��+ 2SO3��+ O2�����ʴ�Ϊ��8FeSO4
4Fe2O3+ 6SO2��+ 2SO3��+ O2�����ʴ�Ϊ��8FeSO4![]() 4Fe2O3+ 6SO2��+ 2SO3��+ O2����
4Fe2O3+ 6SO2��+ 2SO3��+ O2����
��6������A�е�FeSO4�Ƿ���ȫ�ֽ���ֻҪ�����Ƿ�����������Ӽ��ɣ��ʴ�Ϊ������Ӧ��Ĺ���ת����С�ձ��У���������ˮ�����裬���ˣ�ȡ������Һ���Թ��У����뼸��K3[Fe(CN)6]��Һ��������������ɫ������˵��FeSO4û����ȫ�ֽ⣬��֮��ֽ���ȫ��