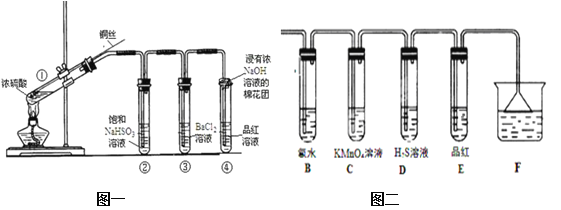
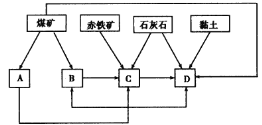
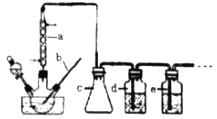
��Ŀ����
����Ŀ��������Ԫ��A��B��C��D��E��ԭ����������������Ԫ��������Ϣ�����
Ԫ�ر�� | Ԫ��������Ϣ |
A | ������ۺ�����۵ľ���ֵ֮��Ϊ2 |
B | ��Eͬ���� |
C | lmo1C����������ˮ��Ӧ���ڱ�״��������11.2LH2 |
D | ԭ�������������������������� |
E | ��һ�������ӵĵ��Ӳ�ṹ��Arԭ����ͬ |
��1�� A�����ڱ��е�λ��Ϊ ��
��2��B��C�γɵĻ�����ĵ���ʽΪ ��
��3��B��D�����ӵİ뾶��СΪ ��
��4��Ԫ�طǽ�����ǿ���Ƚ��кܶ��������B��E�ķǽ�����ǿ�����о������в����е��� (�����)��
A���Ƚ����ֵ��ʵ���ɫ
B���Ƚ����ֵ�����H2���ϵ����׳̶�
C��������Ԫ�������ڱ��е�λ��
D���Ƚ϶�Ӧ�����ӵĻ�ԭ��
e.�Ƚ�����������Ӧˮ���������
��5��EԪ��������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����Է�������Ϊ120.5��������ʵĻ�ѧʽΪ ��
���𰸡���1���ڶ����ڵ���A�壻��2��![]() ����3��F->Al3+����4��a��e����5��NCl3��
����3��F->Al3+����4��a��e����5��NCl3��
�����������������������Ԫ��A��B��C��D��E��ԭ��������������A��������ۺ�����۵ľ���ֵ֮��Ϊ2����A���������Ϊ+5������Ϊ-3������AΪ��A��Ԫ�أ����ԭ��������С��֪AΪNԪ�أ�1molC����������ˮ��Ӧ���ڱ�״��������11.2LH2�����������ʵ���Ϊ��11.2L��22.4L/mol=0.5mol����1molC��ȫ��Ӧʧȥ1mol���ӣ���CΪNaԪ�أ�D��ԭ����������������������������D��ԭ����������Na����DΪ�������ڵ���A��Ԫ�أ�ΪAlԪ�أ�E�ĸ�һ�������ӵĵ��Ӳ�ṹ��Arԭ����ͬ����������Ϊ18-1=17������EΪClԪ�أ�B��Eͬ���壬��BΪFԪ�ء���1�� A��NԪ�أ������ڱ��е�λ��Ϊ�ڶ����ڵ���A�壻��2��BΪFԪ�ء�CΪNaԪ�أ������γɵ������ӻ��������ʽ�ǣ�![]() �� ��3�� BΪFԪ�ء�DΪAlԪ�أ������Ӻ������Ӷ�������ͬ�ĺ�������Ų����˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��СΪ��F-��Al3+����4�� B��FԪ�أ�E��ClԪ�أ�A������ͨ���Ƚ����ֵ��ʵ���ɫ�ж�Ԫ�صķǽ����Ե�ǿ��������B��Ԫ�صķǽ�����Խǿ���䵥�����������Ͼ�Խ���ף����Կ���ͨ���Ƚ����ֵ�����H2���ϵ����׳̶��ж�Ԫ�صķǽ����Ե�ǿ������ȷ��C��Ԫ��ԭ�Ӻ�����Ӳ���Խ�࣬Ԫ�صķǽ����Ծ�Խ�������Կ���������Ԫ�������ڱ��е�λ�ã��ж�Ԫ�صķǽ����Ե�ǿ������ȷ��D�����ӵĻ�ԭ��Խǿ����Ԫ�صķǽ����Ծ�Խ�������Կ��ԱȽ϶�Ӧ�����ӵĻ�ԭ���ж�Ԫ�صķǽ����Ե�ǿ������ȷ��e.һ������£�Ԫ�صķǽ�����Խǿ������ۺ����������Խǿ��������F�Ƿǽ�������ǿ��Ԫ�أ������γɺ��������Բ���ͨ���Ƚ�����������Ӧˮ����������ж�F��Cl�ǽ����Ե�ǿ��������5��EԪ����ClԪ�أ�������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����Է�������Ϊ120.5������CԪ�صĻ��ϼ�Ϊ-1�ۣ�������һ��Ԫ�ػ��ϼ���+3�ۣ������Է���������֪��Ԫ��ΪNԪ�أ��û�����Ļ�ѧʽΪ��NCl3��
�� ��3�� BΪFԪ�ء�DΪAlԪ�أ������Ӻ������Ӷ�������ͬ�ĺ�������Ų����˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��СΪ��F-��Al3+����4�� B��FԪ�أ�E��ClԪ�أ�A������ͨ���Ƚ����ֵ��ʵ���ɫ�ж�Ԫ�صķǽ����Ե�ǿ��������B��Ԫ�صķǽ�����Խǿ���䵥�����������Ͼ�Խ���ף����Կ���ͨ���Ƚ����ֵ�����H2���ϵ����׳̶��ж�Ԫ�صķǽ����Ե�ǿ������ȷ��C��Ԫ��ԭ�Ӻ�����Ӳ���Խ�࣬Ԫ�صķǽ����Ծ�Խ�������Կ���������Ԫ�������ڱ��е�λ�ã��ж�Ԫ�صķǽ����Ե�ǿ������ȷ��D�����ӵĻ�ԭ��Խǿ����Ԫ�صķǽ����Ծ�Խ�������Կ��ԱȽ϶�Ӧ�����ӵĻ�ԭ���ж�Ԫ�صķǽ����Ե�ǿ������ȷ��e.һ������£�Ԫ�صķǽ�����Խǿ������ۺ����������Խǿ��������F�Ƿǽ�������ǿ��Ԫ�أ������γɺ��������Բ���ͨ���Ƚ�����������Ӧˮ����������ж�F��Cl�ǽ����Ե�ǿ��������5��EԪ����ClԪ�أ�������������Ԫ���е�һ��Ԫ���γɹ��ۻ���������е�ԭ�Ӹ�����Ϊ1��3����Է�������Ϊ120.5������CԪ�صĻ��ϼ�Ϊ-1�ۣ�������һ��Ԫ�ػ��ϼ���+3�ۣ������Է���������֪��Ԫ��ΪNԪ�أ��û�����Ļ�ѧʽΪ��NCl3��

 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�