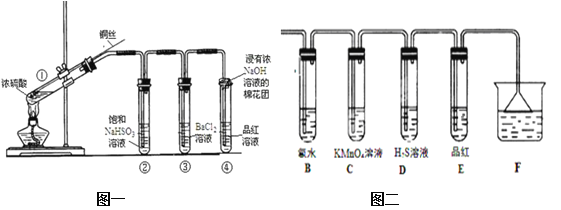
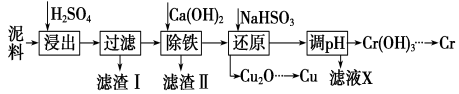
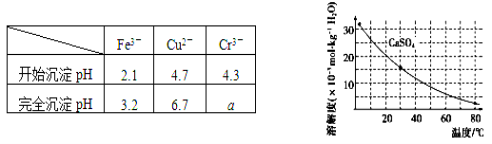
题目内容
【题目】如表所示是元素周期表示意图的一部分,根据表中10种元素,用元素符号或化学式填空。
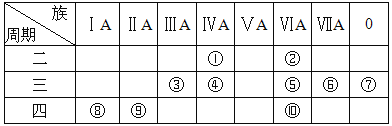
(1)①~⑩元素中,金属性最强的是 (填元素符号);化学性质最不活泼的是 (填元素符号)。
(2)①~⑩元素中,最高价氧化物对应的水化物呈两性的元素是 (填元素符号),该水化物与NaOH溶液反应的离子方程式为 。
(3)①~⑩元素中,最高价氧化物对应的水化物的酸性最强的是 (填化学式),碱性最强的是 (填化学式)。
(4)⑤、⑥、⑧、⑨所形成的简单离子的半径由大到小的顺序是 。(填离子符号)
【答案】(1)K Ar (2) Al Al(OH)3+OH—=AlO2—+2H2O(3)HClO4KOH (4)S2— >Cl— >K+ >Ca2+
【解析】试题分析:由元素在周期表中位置,可知①为C、②为O、③为Al、④为Si、⑤为S、⑥为Cl、⑦为Ar、⑧为K、⑨为Ca、⑩为Se,则
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中K元素金属性最强,稀有气体Ar的化学性质最不活泼;
(2)最高价氧化物对应的水化物呈两性的元素是Al,氢氧化铝是两性氢氧化物,与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为Al(OH)3+OH—=AlO2—+2H2O;
(3)上述元素中,氯元素的最高价氧化物的水化物高氯酸的酸性最强,化学式为HClO4,上述元素中K元素金属性最强,故碱性最强的为KOH;
(4)电子层结构相同,核电荷数越大离子半径越小,故离子半径)S2— >Cl— >K+ >Ca2+。

练习册系列答案
相关题目