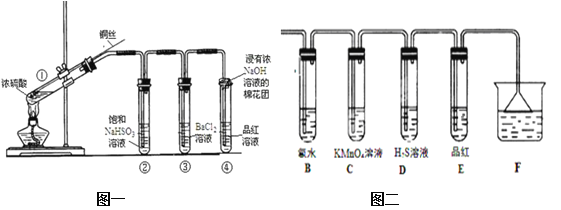
��Ŀ����
����Ŀ��A��B��C��D��E��ǰ������ԭ�������������������Ԫ�ء�AԪ��ԭ�ӵĺ����������������Ӳ�����BԪ�ػ�̬ԭ���������ܼ��Ҹ��ܼ���������ͬ��A��D���γ����ֳ���Һ̬������G��H����ԭ����֮�ȷֱ�Ϊ1��1��2��1��EԪ��ԭ�ӵ�K��L�������֮�͵�����M��N�������֮�͡���ش����и���(�漰Ԫ��������Ӧ��ѧ���ű�ʾ)��
��1��BCD����Ԫ���е縺������Ԫ�����̬ԭ�ӵĵ����Ų�ͼΪ____________��
��2������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ�����____________������������B�Ļ�̬ԭ���У��������____________�������෴�ĵ��ӡ�
��3����E��D�γɵľ�����ͼ1��ʾ��������E2+��Χ�Ⱦ��������E2+��______����ED����ɫ��ӦΪש��ɫ��������������ǵĻ����ﶼ���Է�����ɫ����Ӧ����ԭ����____________��E��B���γɵľ���ľ����ṹ��NaCl���������(��ͼ2��ʾ)�����þ����к��е�������B22-�Ĵ��ڣ�ʹ������һ������������������E2+����λ��Ϊ_______���û�����ĵ���ʽΪ_______��

��4���ø�����������Һ̬Hʱ��һ��H�������ͷų�һ�����ӣ�ͬʱ����һ�������ӡ����ͷų����ĵ��ӿ��Ա�����H�����γɵġ�������������ΪH���Ӽ����γɡ�������ԭ��____________��
����H�����ͷų�����ʱ������һ�������Ӿ��н�ǿ�������ԣ���д������������SO2��ˮ��Һ���� Ӧ�����ӷ���ʽ________________________________________��
���𰸡���1��![]() ��2�������� 2 ��3��12 ��̬ԭ�ӵĵ��ӷ���ԾǨ(��������) 6
��2�������� 2 ��3��12 ��̬ԭ�ӵĵ��ӷ���ԾǨ(��������) 6 ![]() (4 )��ˮ���Ӽ������� ��2H2O++SO2=SO42-+4H+
(4 )��ˮ���Ӽ������� ��2H2O++SO2=SO42-+4H+
��������
���������A��B��C��D��E��F��ǰ������ԭ�������������������Ԫ�أ�AԪ��ԭ�ӵĺ����������������Ӳ�������AΪHԪ�أ�BԪ�ػ�̬ԭ���������ܼ��Ҹ��ܼ���������ͬ����������Ų�ʽΪ1s22s22p2����BΪ̼Ԫ�أ�A��D���γ����ֳ���Һ̬������G��H����ԭ����֮�ȷֱ�Ϊ1��1��2��1����DΪOԪ�ء�GΪH2O2��HΪH2O��C��ԭ����������̼����֮�䣬��CΪNԪ�أ�EԪ��ԭ�ӵ�K��L�������֮�͵�����M��N�������֮�ͣ�ԭ�Ӻ��������Ϊ(2+8)��2=20����EΪCa��
��1��ͬ����������ҵ縺������C��N��O�е縺������Ԫ��ΪOԪ�أ����̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p4����������Ų�ͼΪ![]() ��
��
��2������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ����õ���������������
BΪ̼Ԫ�أ���̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p2���������2�������෴�ĵ��ӣ�
��3��ij�����ᄃ���ṹ��ͼ��ʾ���Զ����E2+�о�����֮�Ⱦ��������E2+λ�����ģ�ÿ������Ϊ8���������ã�ÿ������Ϊ2���������ã��ʾ�����E2+��Χ�Ⱦ��������E2+��![]() =12����
=12����
ED����ɫ��ӦΪש��ɫ��������������ǵĻ����ﶼ���Է�����ɫ��Ӧ����ԭ���ǣ�����̬�ĵ���ԾǨ�����ܼ�ʱ���Թ����ʽ�ͷ�������E��B���γɵľ���ľ����ṹ��NaCl��������ƣ����þ����к��е�������B22-�Ĵ��ڣ�ʹ������һ������������������E2+����λ��Ϊ6���û�����ΪCaC2������ʽΪ![]() ��
��
��4���ø�����������Һ̬ˮʱ��һ��ˮ�������ͷų�һ�����ӣ�ͬʱ����һ��������ΪH2O+��
��ˮ���Ӽ����γɡ�������ԭ���ǣ�ˮ���Ӽ�������������H�����ͷų�����ʱ������һ�������Ӿ��н�ǿ�������ԣ�����������SO2ˮ��Һ��Ӧ���ӷ���ʽΪ��2H2O++SO2=4H++SO42-��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�